
近日,复宏汉霖自主开发的具完全知识产权的HLX20(即重组抗PD-L1全人单克隆抗体注射液,以下简称“该新药”)正式获得国家药品监督管理局颁发的临床试验批件。
复宏汉霖在迅速推进产品研究进程的同时,不断加强国际化战略和单抗联合治疗的布局。此次获批临床研究,是该新药取得的关键研究进展。与此同时,该新药的临床I期试验已于近日在澳大利亚正式启动,未来可广泛用于实体瘤的治疗。
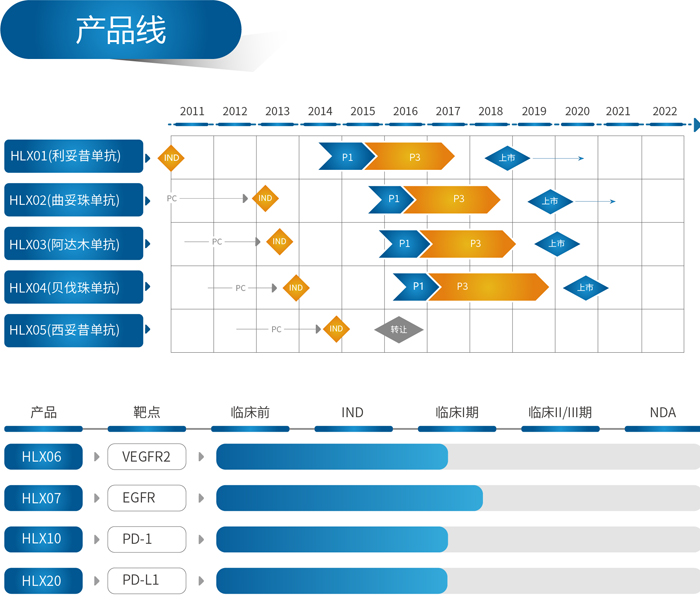
复宏汉霖总裁兼首席执行官刘世高博士表示:“产品的联合治疗就像法国大厨精心烹饪的大餐,唯有丰富的食材来源才能组合成各种美味的菜品。目前,我们的产品管线中已累计有4个创新型产品先后进入临床试验阶段,其中,HLX20(PD-L1单抗)与HLX10(PD-1单抗)是复宏汉霖单抗创新药产品管线中极具代表性的产品,在复宏汉霖肿瘤联合治疗战略中占据重要地位。复宏汉霖将以PD-1单抗和PD-L1单抗为核心,充分利用公司多种产品组合,开发出疗效更佳的联合治疗方案,并全部利用自主开发的产品,以更好的控制开发成本,提高国产生物药的可及性。”
关于PD-1/PD-L1单抗
目前,以PD-1/PD-L1为靶点的抗体药物可广泛用于癌症的免疫疗法,是一类不依据肿瘤来源进行区分的广谱抗癌药物。HLX10和HLX20可通过封阻PD-L1配体与PD-1蛋白受体的结合,从而抑制该信号通路的传导,最终达到活化免疫细胞、杀死肿瘤细胞的作用。2014年以来,美国FDA已批准其适应症从黑色素瘤扩展到非小细胞肺癌、鳞状细胞头颈癌、肾细胞癌、尿路上皮癌、霍奇金淋巴瘤、微卫星不稳定性高或错配修复缺陷的实体瘤及默克尔细胞癌等。
关于复宏汉霖

复宏汉霖由复星医药与海外科学家团队于2009年合资组建,主要致力于单克隆抗体生物类似药、生物改良药以及创新型单抗的研发及产业化。自成立以来,复宏汉霖始终坚守公司“质量•速度•创新”的核心价值观,建立起完善先进的抗体药物研发、产业化技术平台以及丰富的产品管线。其中,公司已有11个产品、17项适应症成功递交IND申请,8个产品在海内外启动临床试验,并在国内率先推出单抗联合治疗,IND申请已获受理。除此之外,公司首个治疗淋巴瘤的产品利妥昔单抗注射液(美罗华®的生物类似药)目前已获国家食品药品监督管理总局(现为国家药品监督管理局)药品注册审评受理,有望打破国产生物类似药市场的空白。日前,复宏汉霖拟募集15,650万美元的融资,公司投后估值约计29.565亿美元。