近日,2024澳门原料网站(2696.HK)宣布,公司创新型BRAFV600E小分子抑制剂HLX208用于治疗BRAFV600E突变的成人朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH)和Erdheim-Chester病(Erdheim-Chester disease,ECD)的II期临床研究(HLX208-LCH/ECD201)结果入选欧洲肿瘤学会亚洲分会(ESMO Asia)年会,以简短口头报告形式展示更新的数据。该研究由中国医学科学院北京协和医学院附属北京协和医院李剑教授牵头开展,试验结果首次发布于2023 ASCO年会。

目前ECD与LCH均被认为属于炎性髓系肿瘤,严重影响患者生存质量,已被中国国家卫生健康委员会(卫健委)纳入《第一批罕见病目录》[1]。根据卫健委发布的《罕见病诊疗指南2019年版》[2],LCH与ECD的主要特征为MAPK/ERK信号通路激活,均存在超过50%的BRAFV600E基因突变率,所以 BRAFV600E是这两种罕见病的重要治疗靶点。HLX208具有全新的化学母核结构,是公司从润新生物引进的具备“同类最佳”潜力的BRAFV600E小分子抑制剂。临床前研究结果表明,HLX208具有单一稳定晶型,良好的口服生物利用度及显著的肿瘤抑制活性。早期临床研究也展现出HLX208具有良好的安全性、耐受性和有效性。2023年4月,HLX208被正式纳入突破性治疗品种名单,用于治疗BRAFV600E突变的LCH和ECD。
此次ESMO Asia年会上公布的数据详情如下:
论文题目
创新型BRAF V600E抑制剂HLX208在携带BRAF V600E突变的朗格汉斯细胞组织细胞增生症和/或Erdheim-Chester病成年患者中的应用
试验设计
在这项单臂、开放标签、多中心的Ⅱ期研究中,组织学确诊的朗格汉斯细胞组织细胞增生症(LCH)和/或Erdheim-Chester病(ECD)患者被纳入并给予每天两次口服HLX208 450 mg,以28天为一个周期。主要终点是由独立影像评估委员会(IRRC)根据实体瘤疗效PET评价标准(PERCIST)1.0评估的ORR。次要终点包括安全性、其他疗效指标以及HLX208的药代动力学特征。
结果
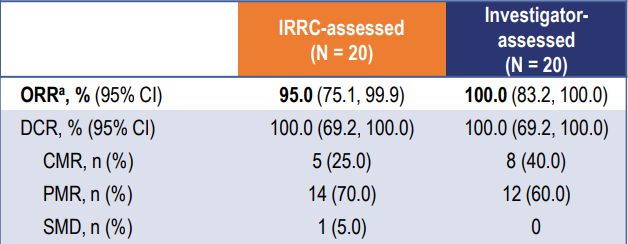
截至2023年7月14日,共有30例患者入组。患者的中位年龄为38.5岁;13(43.3%)例患者为男性。19(63.3%)例患者被诊断为LCH,10(33.3%)例被诊断为ECD,1(3.3%)例为LCH合并ECD。8(26.7%)例患者为单系统多病灶病变,22(73.3%)例为多系统病变。中位随访时间为10.7个月。在20例疗效可评估的患者中,IRRC根据PERCIST 1.0评估的未确认的ORR为95.0%(95% CI 75.1–99.9%)。肿瘤缓解的详细结果见表1。在接受HLX208治疗的30例患者中,有5(16.7%)例报告了3–4级治疗相关不良事件,最常见的是丙氨酸氨基转移酶升高(6.7%)和天门冬氨酸氨基转移酶升高(6.7%)。治疗期间未见导致死亡的不良事件。
表1 根据PERCIST 1.0评估的肿瘤缓解(未确认)
结论
HLX208对携带BRAFV600E突变的LCH和/或ECD成年患者具有良好的疗效,且安全性可控。