火星登陆
药物递送技术指通过制剂方式(主要采用定制载体)实现药物到体内靶点的转运和释放,以提高药物疗效和降低毒副作用的技术手段。通过改变药代动力学,降低药物毒性、增加靶点药物积累等手段,药物递送技术可在空间、时间、剂量等方面对药物在体内分布进行全面的调控[1]。作为医、工、药交叉学科,药物递送不仅研究药物本身,同时关注载体的设计和构建,包括对药物、载体的化学修饰和改性等,是一项多环节交织融合的技术。事实上,药物递送技术的发展是决定诸多潜在疗法是否成功上市的关键。
新冠疫情爆发后,mRNA疫苗加速走向了临床应用,背后即是以脂质体纳米颗粒(LNP)为代表的递送技术的进步,解决了核酸药物结构不稳定、易降解等难题。目前新一代治疗药物,包括蛋白质多肽、单克隆抗体、细胞疗法等,都展现出诱人的治疗潜力,但新疗法同时带来更多递送技术的挑战,如何提高药物稳定性、细胞摄取效率以及给药可行性等问题成为限制新疗法应用的因素。本文介绍了目前较有前景的新型药物递送方案,并讨论了未来药物靶向递送技术的发展方向。
01 脂质体纳米颗粒(LNP)
磷脂在水性溶剂中易呈现封闭的双分子层,形成纳米尺度(20-200 nm)的颗粒,即脂质体纳米颗粒。LNP由阳离子脂质、胆固醇、辅助磷脂和聚乙二醇化磷脂四部分组成,其中阳离子脂质包含带铵根的亲水端,可在酸性环境中结合氢离子带正电,通过静电吸附作用将药物分子包括在LNP中。在LNP被细胞内吞进入内含体后,阳离子脂质可发生电离,破坏内含体膜以实现药物分子逃逸。在静脉注射后,LNP倾向于在肝脏积聚。通过在LNP表面修饰特异性配体,有望调控药物分子的靶向递送。
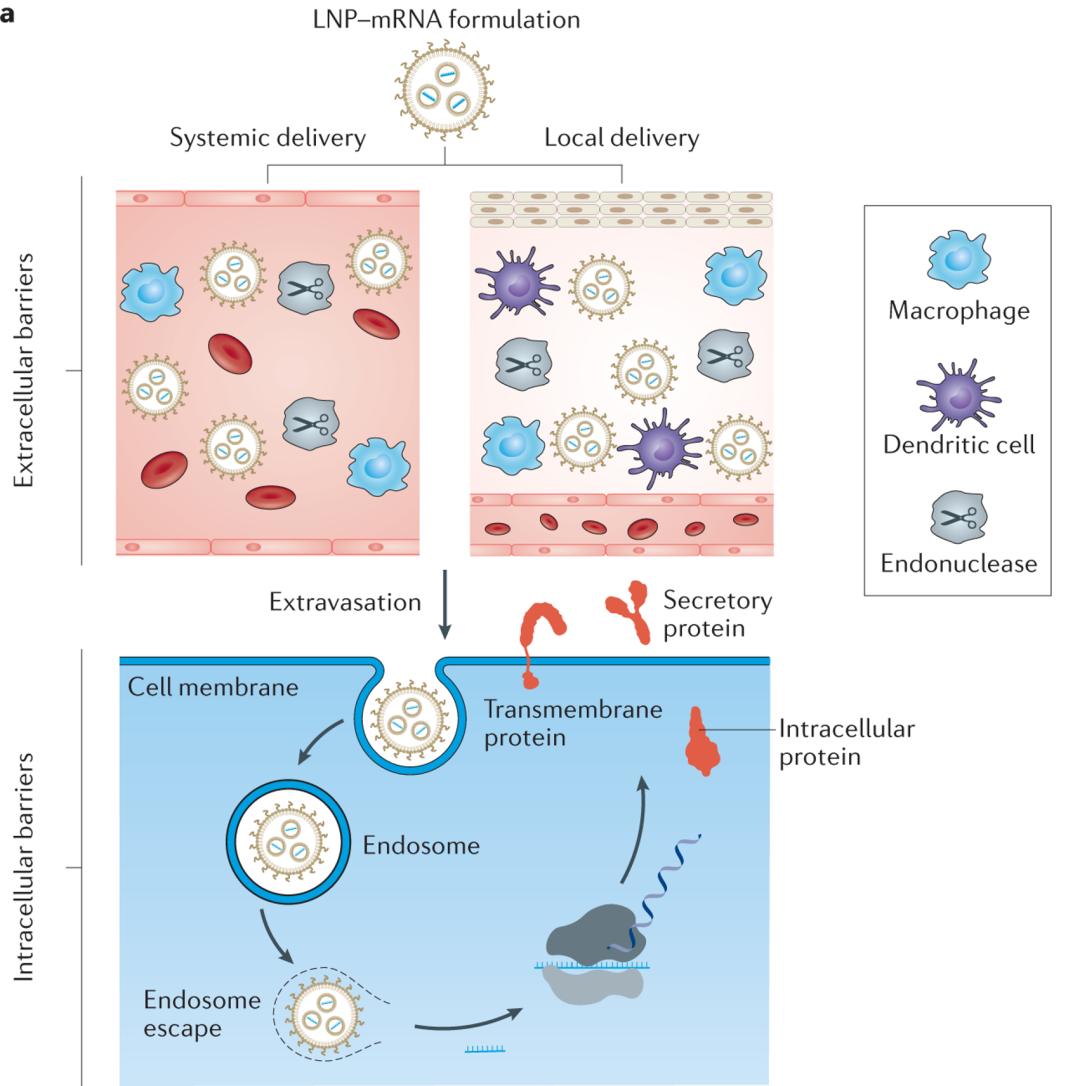
Physiological barriers for lipid nanoparticle–mRNA (LNP–mRNA) formulations post systemic and local delivery. [2]
更有趣的是,研究发现,通过调整脂质的成分也可以将药物精准递送到靶向位点。比如,美国德州大学西南医学中心的Daniel J. Siegwart课题组发现[3],通过添加称为“SORT”(selective organ targeting)分子的成分,可调控LNP在体内的器官靶向特性,实现除肝脏外对肺部、肾脏、脾脏甚至上皮和免疫细胞的靶向递送。
脂质体制剂最早在1995年即被FDA批准用于多柔比星的递送,自此脂质体载体一直处于发展中,直到在新冠疫情中LNP在mRNA疫苗研究中大放异彩,脂质体载体才站在递送技术研究的风头浪尖上。作为核酸药物递送的理想载体,LNP不仅在mRNA,也在反义寡核苷酸(ASO)和siRNA递送中占据重要地位。随着LNP靶向递送技术的不断进步,以及核酸药物关注度的提高,LNP无疑是未来药物递送载体的重要组成部分。
02 N-乙酰半乳糖胺(GalNAc)技术
GalNAc技术是一种基于特定化学修饰的靶向递送技术,主要用于小核酸药物。其原理是,GalNAc对于去唾液酸糖蛋白(ASGPR)有高亲和性,ASGPR主要表达在肝实质细胞表面。因此,通过在小核酸分子上偶联GalNAc,有助于其靶向结合在肝细胞上,随后在内吞作用下GalNAc核酸偶联物被肝细胞摄取,实现高度的肝靶向特异性递送。

GalNAc/ASGPR-Mediated Oligonucleotide Delivery to Hepatocytes[4]
GalNAc递送技术已应用于多种肝靶向核酸药物的递送,其优势包括可通过皮下注射给药、作用时效长、肝靶向特异性强、毒副作用小等。该方法目前仅在小核酸药物尤其是siRNA的递送上有用武之地,并且由于ASGPR表达仅限于肝实质细胞表面,因此,该方法的器官靶向特异性受到严格限制。但这不妨碍GalNAc技术在核酸药物的递送上扮演关键角色。
03 外泌体(exosome)
外泌体来源于内含体,是由多泡体(MVB)与细胞膜融合后释放到胞外的膜状囊泡小体,直径在40-120 nm之间。作为内源性的纳米载体,外泌体免疫原性较低,安全性高。外泌体具有磷脂双分子层结构,在外泌体表面分布有多肽,可设计为与靶细胞上受体特异性结合,从而加速外泌体在靶标位点的富集。在体内,外泌体在细胞远程通讯中扮演重要角色,其可以通过体内循环穿梭于细胞和组织之间,甚至具有可穿越屏障,包括细胞质膜、血脑屏障等的特性。穿过血脑屏障意味着外泌体可进行中枢神经系统的给药研究,有望用于帕金森疾病、恶性胶质瘤等疑难疾病的临床试验中。此外,外泌体具有亲水性内核,能有效装载可溶药物,包括核酸、脂质、小分子、重组蛋白等。
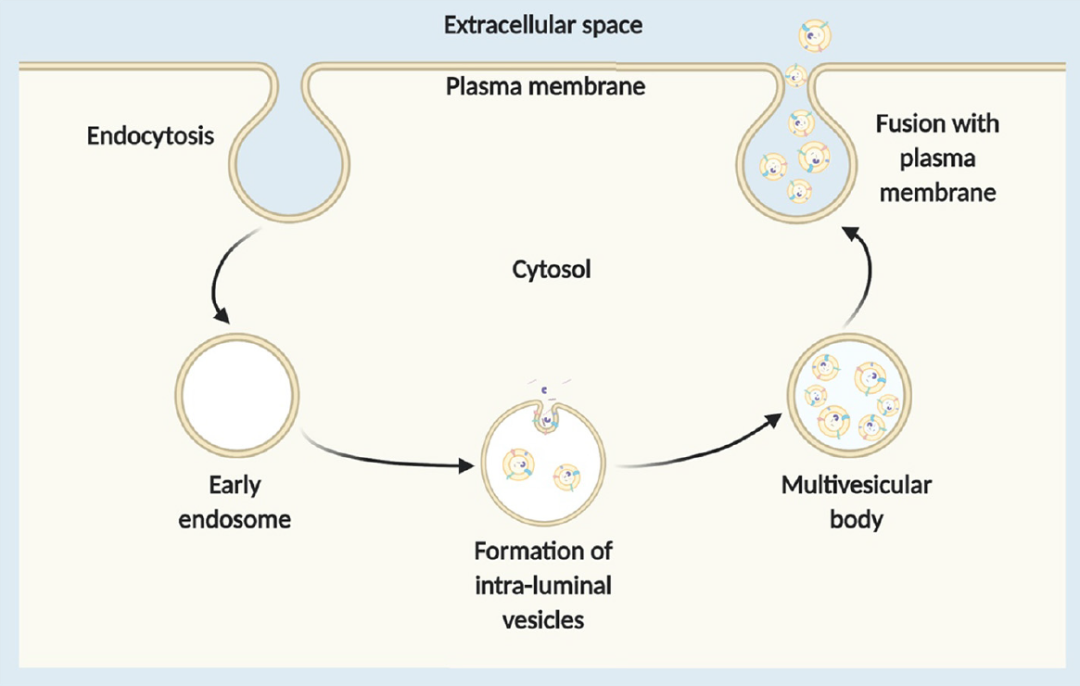
Exosome formation and release from the endosomal pathway[5]
外泌体的应用存在诸多限制,其中关键问题如外泌体的产量尚未满足工业化要求。一般哺乳动物细胞产生的外泌体数量较低,并且外泌体的纯化存在困难。但考虑到外泌体诱人的应用前景,对外泌体的转化研究一直是领域中的热点。比如,一些公司开发了可对外泌体进行工程化改造的技术平台,以实现靶向性的药物递送。
04 核酸纳米载体
核酸纳米载体是指以核酸分子(DNA或RNA)为材料,通过设计核酸序列指导核酸分子自组装为二维或三维的纳米结构,作为药物递送载体的技术。
由于核酸分子的免疫原性低、可设计性强、化学可修饰性强、自身可成药等优点,核酸纳米载体在前沿研究领域广受关注。理论上说,任何药物分子只要和核酸能够偶联,即可采用核酸纳米载体进行递送,包括小分子、蛋白质、多肽等。尤其是在核酸药物的递送中,核酸纳米载体更具有得天独厚的优势。核酸自组装结构一般包括DNA瓦块和DNA折纸,前者由短链相互杂交而成,后者由数百条短链辅助折叠一条长链形成[6]。由于空间大、产率高且易于设计,DNA折纸已被广泛用于小分子或大分子药物的递送研究。此外,通过设计DNA折纸的形状也能对细胞内吞进行有效调控。目前,DNA折纸药物递送的研究主要集中在化疗药物、核酸药物上,通过在折纸上修饰适配体或叶酸分子等,用于肿瘤等疾病的研究。
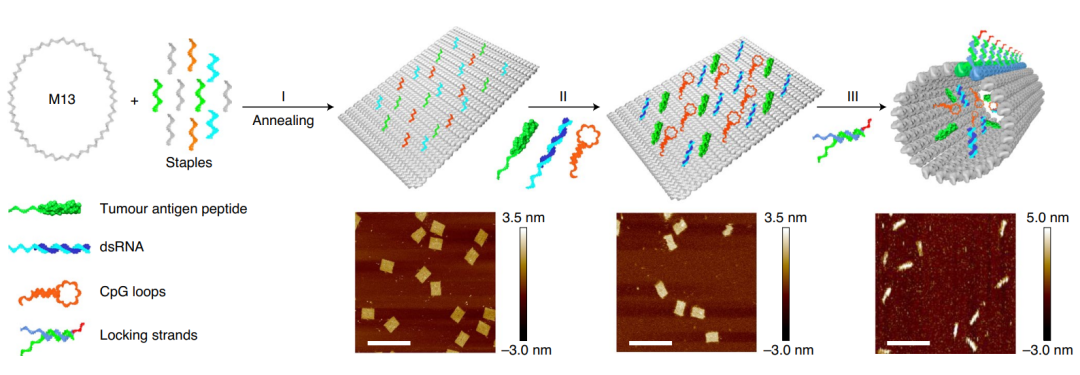
Schematic illustration of the construction of the tumour antigen peptide/CpG loop/dsRNA-co-loaded robotic nanostructure by DNA origami [7]
值得注意的是,除了自组装纳米载体外,球形核酸,即将核酸分子组装在纳米粒子表面形成的三维球状结构,同样在药物递送领域得到了应用,其在临床研究上的进展甚至超过了自组装纳米载体。球形核酸发明人Mirkin教授创建的公司已开展了针对恶性胶质瘤的临床实验,采用球形核酸形式的核酸药物跨越血脑屏障,用于肿瘤治疗[8]。未来,核酸纳米载体凭借丰富的应用场景和可控性强的特点,具有不可估量的市场前景。
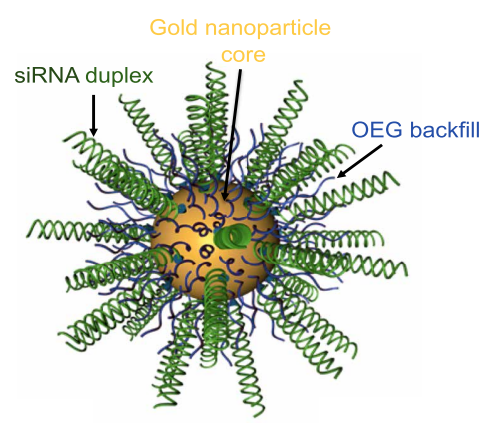
Schematic of NU-0129, a Bcl2L12-targeting, siRNA-based SNA (spherical nucleic acid) [8]
参考文献
[1] A. M. Vargason, A. C. Anselmo, S. Mitragotri, Nature Biomedical Engineering 2021, 5, 951-967
[2] Hou, Xucheng, et al. "Lipid nanoparticles for mRNA delivery." Nature Reviews Materials 6.12 (2021): 1078-1094.
[3] Q. Cheng, T. Wei, L. Farbiak, L. T. Johnson, S. A. Dilliard, D. J. Siegwart, Nat Nanotechnol 2020.
[4] Huang, Yuanyu. "Preclinical and clinical advances of GalNAc-decorated nucleic acid therapeutics." Molecular Therapy-Nucleic Acids 6 (2017: 116-132.
[5] Wang, Jin, Derek Chen, and Emmanuel A. Ho. "Challenges in the development and establishment of exosome-based drug delivery systems." Journal of Controlled Release 329 (2021): 894-906.
[6] N. C. Seeman, Nature 2003, 421, 427-431.
[7] S. Liu, Q. Jiang, X. Zhao, R. Zhao, Y. Wang, Y. Wang, J. Liu, Y. Shang, S. Zhao, T. Wu, A DNA nanodevice-based vaccine for cancer immunotherapy, Nat. Mater. 20 (2021) 421–430.
[8] Kumthekar, Priya, et al. "A first-in-human phase 0 clinical study of RNA interference–based spherical nucleic acids in patients with recurrent glioblastoma." Science translational medicine 13.584 (2021): eabb3945.
我们希望参与这个项目的你
来自全球生命科学领域的顶尖高校、科研院所的博士后、博士、硕士研究生;
一位“顶天立地”的科研工作者 “顶天” - 有敢想敢做向上攀登科研高峰的冲劲,“立地” - 有脚踏实地、目标导向,能将科研设想变为现实的能力及态度。
项目征集要求
个人简历(格式不限)
项目计划书(格式不限)
报名流程及时间
报名及咨询入口