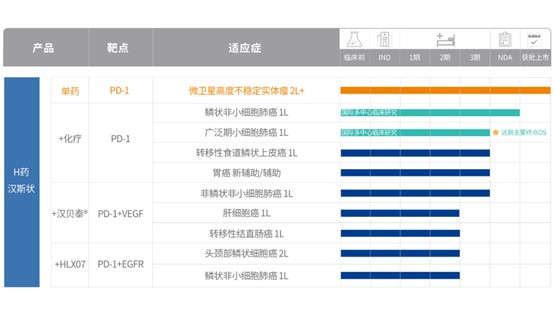
2022年3月25日,上海—复宏汉霖(2696.HK)宣布,旗下首款自主研发的创新生物药PD-1抑制剂H药——汉斯状®(通用名:斯鲁利单抗注射液)正式获得国家药品监督管理局(NMPA)批准,用于经既往标准治疗失败的、不可切除或转移性微卫星高度不稳定(MSI-H)的成人晚期实体瘤适应症,为患者提供治疗新选择,也为国内肿瘤精准免疫治疗赋能添势,助力推进中国生物医药行业高质量发展。

复宏汉霖董事长、执行董事兼首席执行官张文杰表示:“非常高兴看到H药汉斯状®的首个适应症在中国获批,作为国内首批率先开启‘泛癌种’治疗MSI-H实体瘤的PD-1抑制剂,汉斯状®将在临床实践中充分发挥自身优势,助力延长患者高质量生存期,推进肿瘤免疫治疗加速发展。H药是公司第5个上市的产品,作为创新升级的重大成果将进一步推动公司向Biopharma进化,促进更多以患者需求为核心的创新产出。”
H药汉斯状®关键性II期临床研究主要联合研究者、南京金陵医院肿瘤中心秦叔逵教授表示:“以PD-1抑制剂为代表的免疫检查点抑制剂已在众多疾病领域展开了积极的探索,并在多个肿瘤治疗领域取得了突破性的进展。汉斯状®针对MSI-H实体瘤的临床研究数据优异,相信能够积极改善临床疗效,为中国肿瘤精准治疗提供新思路和新选择。”
H药汉斯状®关键性II期临床研究主要联合研究者、上海同济大学附属东方医院肿瘤科李进教授指出:“汉斯状®的获批上市给MSI-H实体瘤患者带去了新希望,更好地满足肿瘤临床治疗用药需求,该产品在推动国内肿瘤治疗发展的同时,对于提升‘泛癌种’治疗认知及推动肿瘤精准免疫治疗发展起到了积极的作用。”
“泛癌种”治疗惠及更广泛患者
此次获批主要是基于一项单臂、多中心、关键性II期临床研究,该试验的主要终点为独立影像评估委员会(IRRC)依据RECIST v1.1标准评估的客观缓解率(ORR)。截止到2021年7月10日,本试验共入组108名患者,其中68名经中心实验室或研究中心确认MSI-H的患者被纳入主要疗效分析人群。主要疗效分析人群中,经IRRC评估的ORR为39.7%(95%CI:28.03,52.30; 3例完全缓解,24例部分缓解)。研究结果表明,H药单药治疗既往标准治疗失败的、不可切除或转移性MSI-H实体瘤获益显著,达到预设的主要终点标准,且具有良好的安全性和耐受性。该项临床试验结果以口头汇报形式于第24届全国临床肿瘤学大会暨2021年CSCO学术年会上首次发布。
“微卫星 (Microsatellite)” 是基因中的一类短串联重复DNA序列,在DNA复制时插入或缺失引起微卫星序列长度的改变,被称为微卫星不稳定(Microsatellite Instability, MSI)[1] 。大量研究表明,MSI与肿瘤的发生密切相关,在临床实践中,MSI已成为部分实体瘤预后和制定辅助治疗方案的重要生物标志物。在MSI的分类中,2种或2种以上位点改变被称为微卫星高度不稳定(MSI-H),常见于子宫内膜癌、结直肠癌、胃癌等癌症,此类患者通常对于免疫检查点抑制剂有较高的应答率[2-3],PD-1/PD-L1作为重要的免疫抑制分子对于MSI-H特征型实体瘤患者具有较好的治疗效果。据统计,中国每年新发MSI-H肿瘤患者逾30万[4],其中部分患者缺乏有效治疗,并且,目前我国鲜有针对MSI-H晚期实体瘤获批的PD-1抑制剂,临床治疗需求远未被满足。H药的“横空出世”为国内治疗该适应症再添“利器”,将在实际临床中以独特的创新和高品质提升肿瘤临床诊疗能力,实现患者获益最大化,推动构建肿瘤防治体系建设。
国际品质助力海外市场布局
围绕H药,复宏汉霖已在全球开展并加速推进多元化的肿瘤免疫联合疗法,广泛覆盖肺癌、食管癌、头颈癌和胃癌等高发癌种,全面覆盖肺癌一线治疗。截至目前,H药全球累计入组超2800受试者,是拥有国际临床数据较多的PD-1抑制剂之一,为未来在全球范围内的上市注册申请打下扎实基础。值得一提的是,该产品针对鳞状非小细胞肺癌(sqNSCLC)和广泛期小细胞肺癌(ES-SCLC)的两项国际多中心III期临床试验在中国、土耳其、波兰、格鲁吉亚等国家和地区先后开设了研究中心,入组的高加索人群占比超30%,为临床研究提供了更全面的病例数据。其中治疗局部晚期或转移性sqNSCLC的NDA已获NMPA受理,有望今年获批上市。H药联合化疗一线治疗ES-SCLC的国际多中心III期研究已达到主要终点总生存期(OS),公司计划于2022年在中国及欧盟递交该适应症的上市注册申请,H药有望成为全球首个一线治疗SCLC的PD-1抑制剂。
在开展国际多中心临床研究的同时,复宏汉霖也在积极规划H药的海外商业化布局。早在2019年公司即与PT Kalbe Genexine Biologics(KG Bio)达成合作,授予其H药首个单药疗法及两项联合疗法在东南亚地区10个国家的独家开发和商业化权利。接下来,公司将携手更多商业合作伙伴,稳健持续拓展H药的海外布局,以优质的国际品质走上世界PD-1的舞台。
未来,复宏汉霖将持续以患者需求为核心,凭借高效及创新的自主核心能力持续推进更多汉霖“质”造,为中国乃至全球患者提供最高品质的药物和服务,打造生物制药领域民族品牌。
关于 H药—汉斯状®
H药汉斯状®为重组人源化抗PD-1单抗注射液(通用名:斯鲁利单抗注射液),是复宏汉霖首个自主研发的创新型单抗,该产品已获批用于治疗微卫星高度不稳定(MSI-H)实体瘤。围绕H药,复宏汉霖积极推进其与公司其他产品的协同以及与创新疗法的联合,相继获得中国、美国、欧盟等国家及地区的临床试验许可,在全球同步开展9项肿瘤免疫联合疗法临床试验,广泛覆盖肺癌、食管癌、头颈癌和胃癌等适应症,全面覆盖肺癌一线治疗。截至目前,H药已于中国、土耳其、波兰、格鲁吉亚等国家和地区累计入组超2800人,其中2项国际多中心临床试验入组高加索人种的比例超过30%,是拥有国际临床数据较多的抗PD-1单抗之一。H药联合化疗治疗局部晚期或转移性鳞状非小细胞肺癌(sqNSCLC)的NDA已获得NMPA受理,有望今年获批。H药联合化疗一线治疗广泛期小细胞肺癌(ES-SCLC)的国际多中心III期研究达到主要终点总生存期(OS),公司计划于2022年在中国及欧盟递交该适应症的上市注册申请,有望成为全球首个一线治疗SCLC的抗PD-1单抗。
参考文献
[1] Thibodeau S N, Bren G, Schaid D. Microsatellite instability in cancer of the proximal colon[J]. Science, 1993, 260(5109): 816-819.
[2] Michael J Overman, Ray McDermott, Joseph L Leach, et al. Nivolumab in patients with metastatic DNA mismatch repair deficient/microsatelliteinstability-high colorectal cancer (CheckMate 142): results of an open-label,multicenter, phase 2 study[J]. Lancet Oncology, 2017,18(9):1182-1191.
[3] Aurelien Marabelle, Dung T Le, Paolo A Asciert, et al. Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase IIKEYNOTE-158 Study[J]. J Clin Oncol, 2020, 38(1): 1-10.
[4] Chen, W., et al., Cancer statistics in China, 2015. CA Cancer J Clin, 2016.