2020年5月27日,2024澳门原料网站(香港联交所代码:2696)今日宣布,公司自主研制的Denosumab生物类似药HLX14(重组抗RANKL全人单克隆抗体注射液)正式获得国家药品监督管理局(NMPA)临床试验批准,适应症为高危骨折风险的女性绝经后骨质疏松症。
作为全球骨质疏松症患者最多的国家,中国拥有超过1亿的骨质疏松症患者,且集中分布于绝经后妇女及老年人群[1]。研究表明,骨质疏松症易导致骨折等一系列健康问题,严重影响着人们的生活质量。目前,全球范围内骨质疏松症就诊率和规范化治疗率尚且较低,随着患者人群的持续增长,骨质疏松症患者的巨大治疗需求亟待满足[2]。
RANKL(receptor activator of nuclear factor kappa B ligand,NF-κB受体活化因子配体)属于肿瘤坏死因子(tumour necrosis factor, TNF)配体超家族成员,在骨吸收的调控中发挥关键作用。通过特异性地结合RANKL,HLX14可阻断RANKL与破骨细胞表面的NF-κB受体活化因子(RANK)结合,阻止RANKL/RANK介导的破骨细胞的分化、成熟及活化,进而减少骨吸收,增加患者骨密度,降低患者骨折的风险[3]。
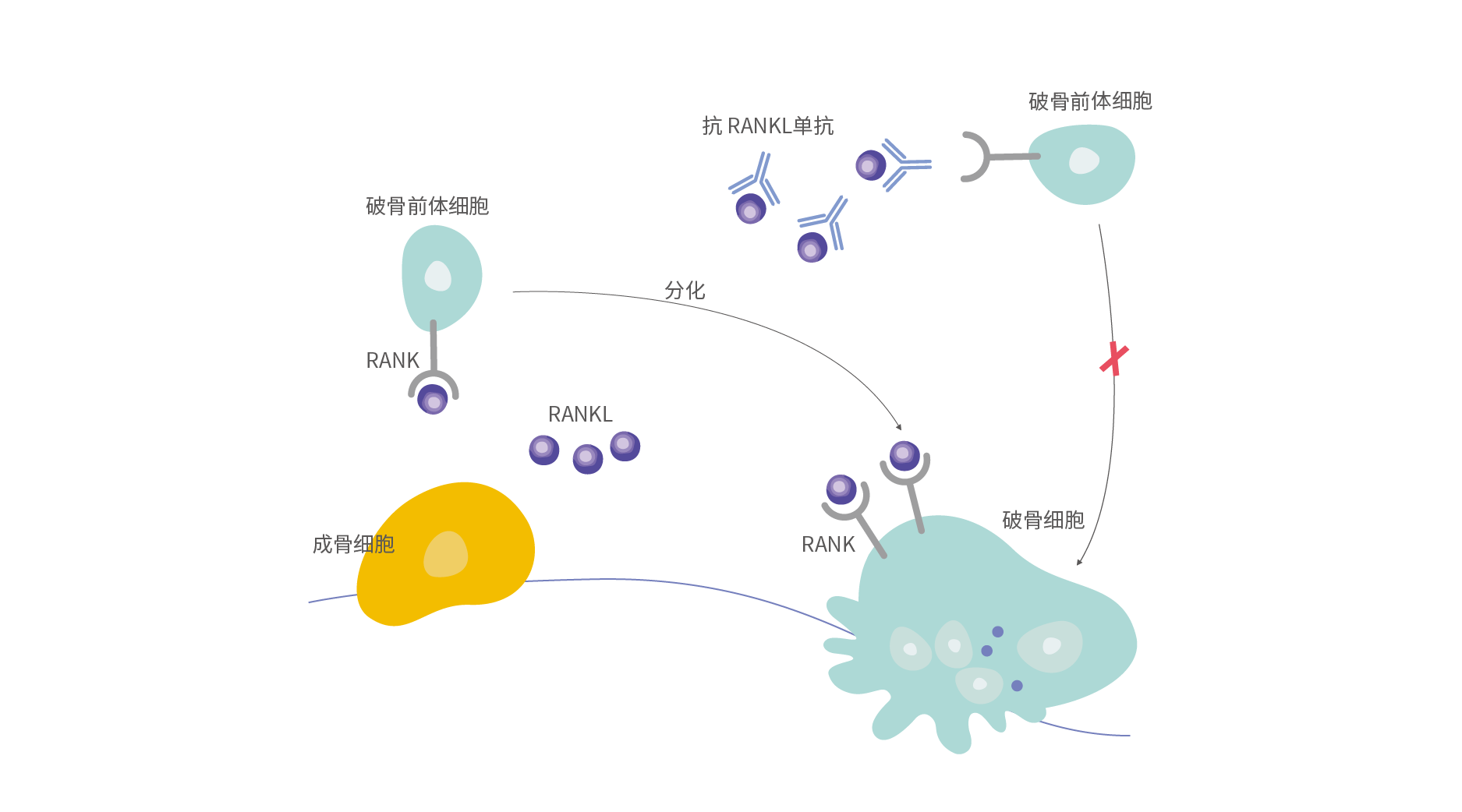
抗RANKL单抗作用机制示意图
参照国家药品监督管理局药品审评中心(CDE) 发布的《生物类似药研发与评价技术指导原则(试行)》以及 欧洲药品管理局(EMA)发布的“Guideline on Similar Biological Medicinal Products”的要求,2024澳门原料网站遵循逐步递进、比对及相似性评价原则,对 HLX14与原研药Denosumab (英文商品名:Prolia®)进行了头对头比较。研究结果表明,HLX14与原研药在临床前药理学、毒理学及药代动力学方面皆高度相似,有望为高骨折风险的骨质疏松症患者带来新的质高价优的选择。
2024澳门原料网站前瞻性布局了一个多元化、高质量的产品管线,覆盖了多个可在近期实现商业化的候选单抗生物类似药。2019年2月中国首款生物类似药汉利康®获批之后,2024澳门原料网站另外两款重磅产品HLX03(阿达木单抗注射液)与HLX02(注射用曲妥珠单抗)的新药上市申请已先后获国家药监局受理并纳入优先审评程序,有望于今年上市。HLX14的开发将有助于进一步拓展2024澳门原料网站丰富的产品管线,更是拓宽公司疾病领域布局的积极探索。
此外,2024澳门原料网站在生物创新药和联合疗法均有积极布局,在全球多地快速推进创新产品临床研究的同时,积极打造多元化的、基于自有产品(以抗PD-1/PD-L1单抗等为核心)的联合疗法组合。未来,2024澳门原料网站将持续引领创新生物药的开发,凭借已经建立起的完善的创新研发平台,持续高效地为全球患者提供可负担的、疗效更好的治疗方案。