近日,復宏漢霖自主研制的新藥HLX02——注射用重組抗HER2人源化單克隆抗體(以下簡稱“該新藥”)正式收到波蘭藥品注冊辦公室批準,可于當地開展轉移性乳腺癌適應症的III期臨床試驗,與此同時,復宏漢霖HLX02項目已同步在國內開展並獲準于烏克蘭開展III期國際多中心臨床試驗研究。
原研藥高價難負擔 國內醫療需求遠未被滿足
在華銷售額自上市以來保持穩定增長,該産品在華銷售額于2015年達到20億人民幣。根據IMS資料,2016年度,全球已上市HER2抑制劑(用于轉移性乳腺癌適應症)于全球銷售額約為80.9億美元。然而,由于原研藥昂貴的治療費用,國內尚無赫賽汀的競爭品或替代品,很多乳腺癌患者因負擔不起而得不到應有的治療,原研藥滲透率占比極低。
截至2017年8月,本集團針對該新藥(包括轉移性乳腺癌適應症及轉移性胃癌適應症)已投入研發費用約人民幣22,900萬元。

國內首個可開展國際多中心III期臨床研究的赫賽汀®生物類似藥
2015年7月,該新藥獲得了CFDA乳腺癌適應症的臨床研究批件,隨後復宏漢霖采用歐盟質量標準,率先與原研藥做頭對頭試驗,于中國境內(不包括港澳台地區)完成I期臨床研究。I期臨床研究結果證實,該新藥安全,與原研藥赫賽汀®等效。今年5月,烏克蘭衛生部正式批準該新藥用于轉移性乳腺癌適應症的III期臨床試驗。目前,該新藥在國內III期臨床研究已經全面展開,成為國內首個可開展國際多中心III期臨床研究的赫賽汀®生物類似藥。隨著復宏漢霖國際化布局的逐步完善,未來該新藥將于更多國際中心進行III期臨床研究(招募信息見下文)。
持續創新,卓越運營;以優質生物藥,造福全球病患
復宏漢霖以單抗類似藥為先導,通過搭建成熟的單抗藥物研發平台,快速推進研發進度,旨在提高靶向治療藥物的可及性,惠及全球更多癌症患者。以創新與國際化為主要發展方向, 未來,複宏漢霖在持續開發多個創新單抗産品的同時,亦將持續加大國際化力度,以病患為中心積極做到産品的可及性與可負擔性,以病患為中心。肩負“持續創新,卓越運營;以優質生物藥,造福全球病患”的偉大使命,複宏漢霖將不斷探索發展,專注提供質高價優的生物藥,致力于成為全球最受景仰的創新生物醫藥公司!
復星醫藥始終將自主創新作為企業發展的源動力,持續完善“仿創結合”的藥品研發創新體系。近年來,公司持續加大研發投入,已形成國際化的研發布局和較強的研發能力。

主要入選標準
1. ≥18歲的復發性或轉移性乳腺癌患者,無法實施根治手術
(最終入選標準由研究者評估)
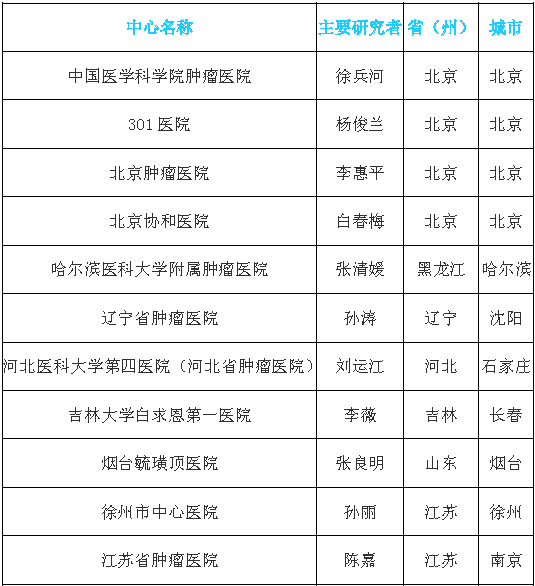
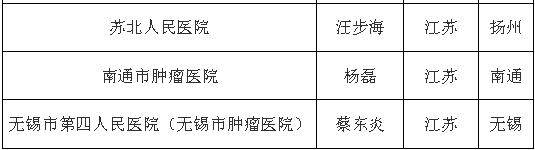
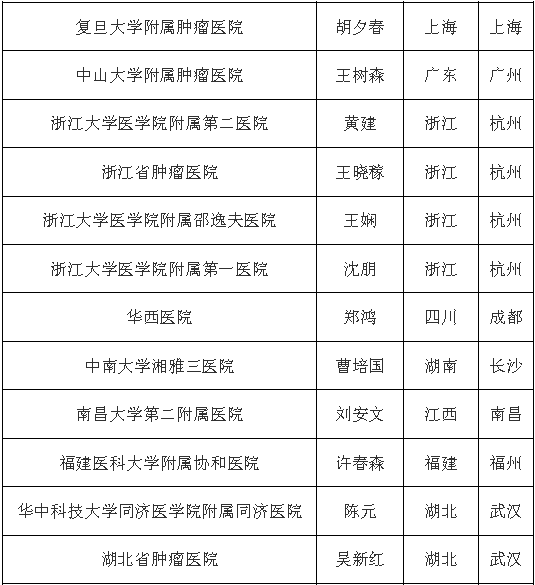
中國臨床機構名單
(此處僅為部分醫院名單)
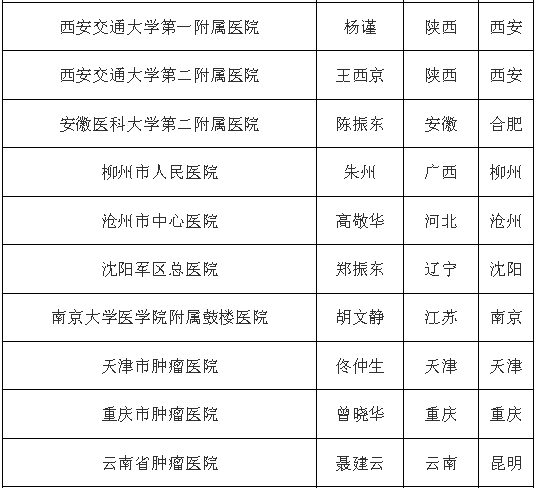
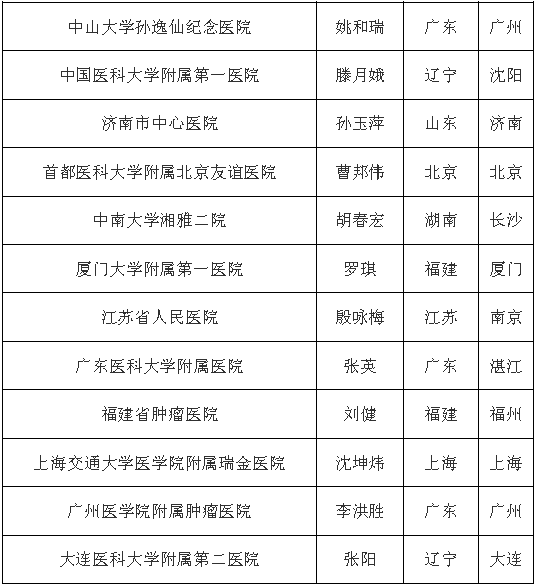
研究相關檢查免費(包括CT,核磁,血液檢查等);
規範化的治療、檢查、隨訪 一定的交通補助。
或與上述研究人員和機構(醫院)的藥物臨床試驗辦公室取得聯系。
