復星醫藥三大新葯獲批臨床試驗
14日,復星醫藥發布公告,旗下子公司的三大新葯獲得了國家食葯監的臨床試驗批准。具體情況是這樣的↓↓↓
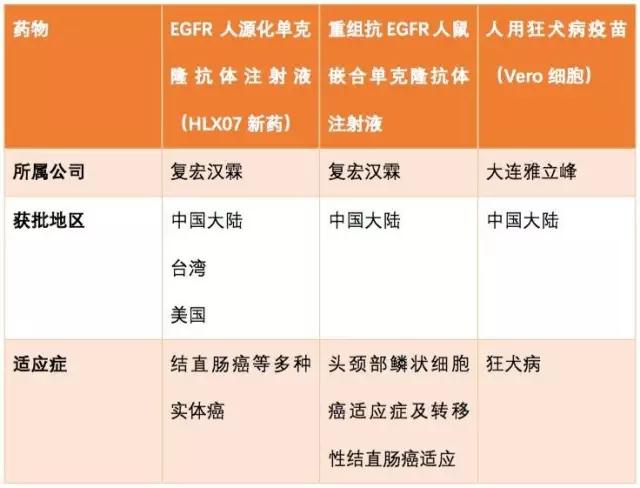
小編來劃重點:1、復星醫藥子公司復宏漢霖的HLX07新葯已獲三地臨床批准,分別是中國大陸、台灣和美國。2、復宏漢霖的重組抗EGFR人鼠嵌合單克隆抗體注射液已獲得用於轉移性結直腸癌適應症臨床試驗的批准,此次獲批的是該新葯的第二個適應症試驗。
HLX07新葯可是復宏漢霖的第一個創新型生物改良型單抗,之前的復宏漢霖做的都是生物類似葯,如今終於能做擁有完全自主知識產權的創新生物改良藥的研發。更重要的是,這個葯在三地做了臨床申報,實現了研發產品的國際化。
小編查了下復宏漢霖官網,這家公司是由上海復星醫藥(集團)與美國科學家團隊於2009年12月合資組建,公司註冊資金3511萬美元,約累計投入4億多元用於單抗藥物的前期研發。
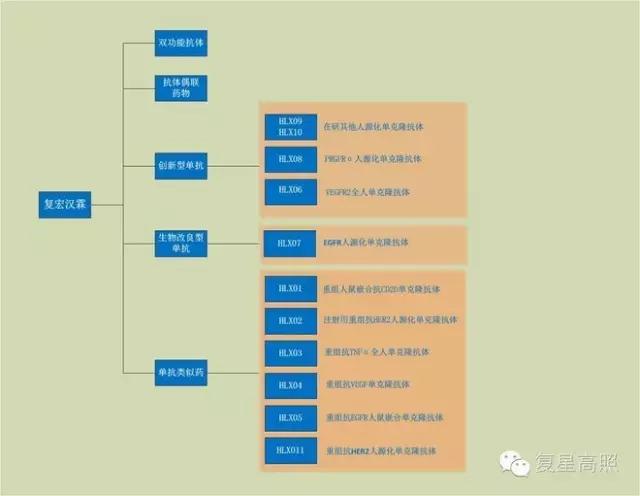
這家公司做了啥?看下產品就知道↓↓↓
復宏漢霖的研發團隊核心人員都曾在國外大型醫藥企業從事過多個單抗藥物的前期研發以及單抗藥物產業化。在中國上海、美國加州和台北都有研發實驗室,其中上海實驗室總面積大約4,300平方米,完成了單克隆抗體藥物開發平台的建設。
這些藥物都是幹啥的?復宏漢霖CEO劉世高是這麼解釋單克隆抗體的:它是一種大分子蛋白,由單一B 細胞克隆產生的高度特異的、均一的抗體。與傳統小分子藥物相比,單克隆抗體藥物具有靶向性好,療效確切,毒副反應小等優勢。目前,單克隆抗體藥物已經成為腫瘤和自身免疫疾病等重大疑難病症的高端首選治療用藥。
復宏漢霖在這一領域是領跑者。
截至目前,復宏漢霖團隊已完成6個產品、10項適應症IND申報的高效研發,位於國內同行業領先地位。
復宏漢霖CEO劉世高在接受採訪時說,復宏漢霖的第一個單抗項目HLX01 於2014 年3 月獲得CFDA的NHL 適應症的臨床批件(包括臨床I、II、III 期試驗),這是我國第一個批准臨床試驗的單抗生物類似葯。2015 年5月,公司HLX01 項目RA 適應症也獲得了臨床批准。復宏漢霖迅速成長為該領域的領軍企業,用實力登上生物製藥的“金字塔尖”。
生物葯布局姿勢大比拼
劉世高曾說過,和小分子仿製葯相比,生物藥單抗研發門檻要高很多,企業必須擁有精湛高效的技術團隊和先進的生產設備及工藝設計方能進行。目前的葯企都是怎麼做研發的呢?
葯企發展生物葯主要是三種姿勢,一種是依靠自有團隊的研發,選這類姿勢的通常是“小而美”的中小型的生物製藥公司。第二種是另設子公司研發,最典型的就是復星醫藥啦。還有一種是依託收編來增加實力。
姿勢一:“小而美”公司做自主研發
首先看下自主研發的“小而美”生物製藥公司,它們雖然規模不大,但研發實力強勁,並且估值驚人
姿勢二:再建個子公司來做研發
復星醫藥採取的就是這種姿勢。
在合資建立復宏漢霖後,復星醫藥還幾次增資,現在差不多擁有復宏漢霖86.39%的股份,而且給復宏漢霖研發的錢也是記入了復星醫藥的成本。統計顯示,2016年上半年,復星醫藥花了4.89億人民幣做研發,比2015年漲了37.06%。其中,藥品製造與研發板塊的研發費用為人民幣2.43億元,占藥品製造與研發板塊業務收入的5%。
大力研發同樣帶來了很可觀的回報,到今年上半年為止,復星醫藥擁有在研新葯、仿製葯、生物類似葯及疫苗等項目172項,僅今年上半年,就有22個產品獲得臨床批件。其中,藥品製造與研發板塊專利申請達37項,包括美國專利13項、PCT申請2項;獲得專利授權13項,均為發明專利。
從創新葯的實現路徑上來看,復星醫藥這個模式是有自己的特色的。目前,復星醫藥正在持續完善“仿創結合”的藥品研發體系,在小分子化學創新葯、大分子生物類似葯、高價值仿製葯、特色製劑技術等領域都做出了不錯的成績。
復星醫藥的創新有着很明確的戰略規劃,其總裁兼首席運營官吳以芳說:“復星醫藥研發創新發展將分為三個階段:近期,將着力於打造創新能力,包括人才架構、基礎設施配套、臨床能力的建設等;中期,將走‘仿創並舉’的道路;遠期,將努力成為一個完全創新型的企業。”
姿勢三:自己做不如直接收編
要做一個生物新葯的話,很可能必須建設自己的廠房、生產線等,在這方面要花大量的時間和精力。
