近期,復宏漢霖自主開發和生產的漢曲優®(曲妥珠單抗,歐洲商品名:Zercepac®,澳大利亞商品名:Tuzucip®和Trastucip®)接連在泰國和菲律賓獲得批准上市,商品名分別為TRAZHER®和Hertumab®,用於HER2陽性乳腺癌和胃癌的治療。此前,漢曲優®已在新加坡、柬埔寨等東南亞國家成功獲批上市。截至目前,該產品已在全球超過40個國家和地區獲批上市。
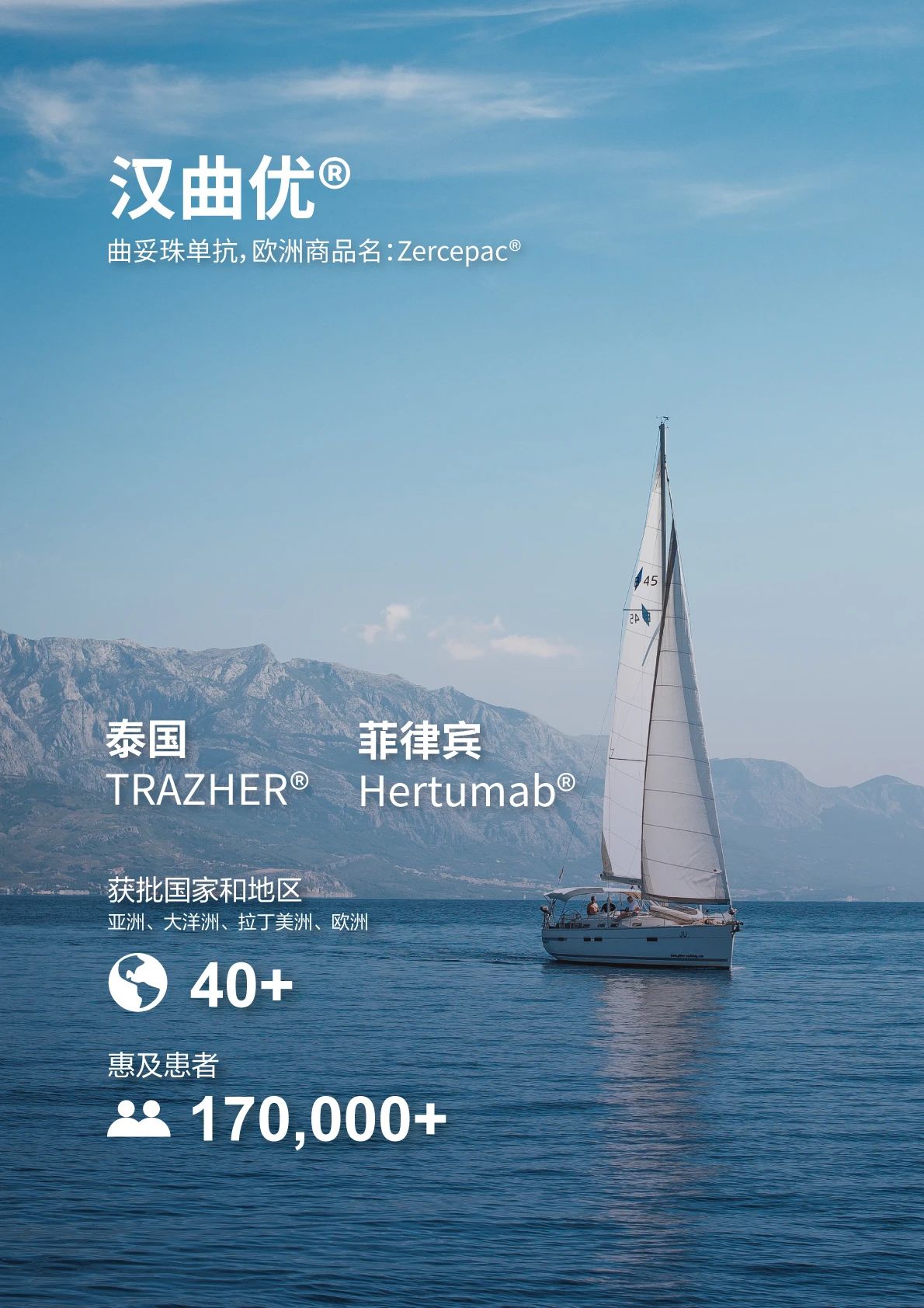
乳腺癌是東南亞發病率最高的惡性腫瘤,2022年該區域乳腺癌新發病例近17萬例[1]。HER2過表達的乳腺癌約占乳腺癌總數的15%-20%[2]。另一方面,胃癌患者的HER2過表達比率約為12%-23%[3]。曲妥珠單抗是治療HER2陽性乳腺癌和胃癌的基石類藥物,並作為一線治療方案被納入美國國家綜合癌症網絡(NCCN)指南、中國臨床腫瘤協會(CSCO)診療指南、歐洲腫瘤內科學會(ESMO)指南等[3-9]。目前,復宏漢霖正與KGbio在多個東南亞國家合作推進漢曲優®在該區域市場的商業化進程,為當地患者提供更多高效、安全的治療選擇,助力推動當地醫療水平的不斷進步,提升優質生物藥在新興市場的可及性。
漢曲優®是復宏漢霖按照中國、歐盟和美國等生物類似藥法規自主研發的曲妥珠單抗生物類似藥,於2020年7月及8月先後獲得歐盟委員會與中國國家藥監局(NMPA)批准上市,為首個中國自主研發的中歐雙批單抗藥物,並有望成為首個在中國、歐盟、美國獲批的「中國籍」生物類似藥。其美國上市許可申請已獲得美國FDA受理,預計將於2024年獲批。自上市以來,漢曲優®(歐洲商品名:Zercepac®,澳大利亞商品名:Tuzucip®和Trastucip®)已成功於中國、英國、法國、德國、瑞士、澳大利亞、芬蘭、西班牙、阿根廷、沙特阿拉伯、新加坡等超過40個國家和地區獲批上市,覆蓋亞洲、大洋洲、拉丁美洲和歐洲,並進入中國、英國、法國和德國等多個國家的醫保目錄。截至目前,漢曲優®(歐洲商品名:Zercepac®,澳大利亞商品名:Tuzucip®和Trastucip®)已惠及逾17萬名患者。
漢曲優®的生產和質量控制環節遵循國際最高標準,其生產基地及配套的質量管理體系相繼獲得中歐雙GMP認證,通過了由中國國家藥監局(NMPA)、歐洲藥品管理局(EMA)、歐盟質量受權人(QP)及公司國際商業合作夥伴進行的多項實地核查及審計,並於2023年接受了美國FDA的批准前檢查(Pre-licensing Inspection, PLI)。復宏漢霖現有48,000升商業化產能,可為公司已上市產品提供商業化生產,並已實現全球產品常態化供應,全面覆蓋中國、歐洲、東南亞及拉丁美洲。公司亦持續推進產能擴增,2026年公司總商業化產能預計可達144,000升,有望進一步滿足日益增長的全球市場需求。
圍繞漢曲優®,復宏漢霖亦前瞻性地開展了國際商業化布局,攜手Accord、Abbott、Eurofarma、Elea和KGbio等國際一流的生物製藥企業,在進軍歐美主流生物藥市場的同時,加快落子新興市場,對外授權已覆蓋全球約100個國家和地區。未來,復宏漢霖將繼續推進漢曲優®在更多國家和地區的獲批上市,以高品質生物藥造福全球患者。
【參考文獻】
[1] Ferlay J, Ervik M, Lam F, Laversanne M, Colombet M, Mery L, Piñeros M, Znaor A, Soerjomataram I, Bray F (2020). Global Cancer Observatory: Cancer Today. Lyon, France: International Agency for Research on Cancer. Available from: https://gco.iarc.who.int/today, accessed [29 January 2024]
[2] American Cancer Society. Cancer Facts and Figures 2024. Atlanta: American Cancer Society; 2024.
[3] NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Gastric Cancer V.3.2023
[4] NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Breast Cancer V.1.2024
[5] Loibl S, André F, Bachelot T, et al. Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2024;35(2):159-182. doi:10.1016/j.annonc.2023.11.016
[6] Gennari A, André F, Barrios CH, et al. ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Ann Oncol. 2021;32(12):1475-1495. doi:10.1016/j.annonc.2021.09.019
[7] Gennari A, André F, Barrios CH, et al. ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Ann Oncol. 2021;32(12):1475-1495. doi:10.1016/j.annonc.2021.09.019
[8] Chinese Society of Clinical Oncology (CSCO) Breast Cancer Guidelines 2023
[9] Chinese Society of Clinical Oncology (CSCO) Gastric Cancer Guidelines 2023
