近日,復宏漢霖自主開發的創新型產品H藥 漢斯狀®(斯魯利單抗,抗PD-1單抗)、抗EGFR單抗HLX07、抗LAG-3單抗HLX26在晚期實體瘤患者中開展的多項I/II期臨床研究成果入選2023 ESMO Asia年會,以壁報的形式進行現場展示,包括由復旦大學附屬中山醫院樊嘉教授牽頭開展的HLX10-008-HCC201,廣東省人民醫院吳一龍教授牽頭開展的HLX10HLX07-sqNSCLC-201,南方醫科大學南方醫院李常興教授牽頭開展的HLX07-CSCC201,及徐州市中心醫院武焱旻教授牽頭開展的HLX26-002。其中,HLX07-CSCC201研究結果獲評本屆大會「最佳壁報」獎。
H藥 漢斯狀®(斯魯利單抗)
H藥 漢斯狀®為復宏漢霖自主開發的重組人源化抗PD-1單抗注射液(通用名:斯魯利單抗注射液),是全球首個獲批一線治療小細胞肺癌的抗PD-1單抗。自2022年3月獲批上市以來,H藥目前可用於治療微衛星高度不穩定(MSI-H)實體瘤、鱗狀非小細胞肺癌(sqNSCLC),廣泛期小細胞肺癌(ES-SCLC)及食管鱗狀細胞癌(ESCC)四項適應症。此外,H藥聯合化療一線治療廣泛期小細胞肺癌(ES-SCLC)的上市申請也已經獲得歐盟EMA受理,有望於2024年上半年獲批。聚焦肺癌和消化道腫瘤,復宏漢霖積極推進H藥與公司其他產品的協同以及與創新療法的聯合,相繼獲得中國、美國、歐盟等國家及地區的臨床試驗許可,在全球同步開展10餘項腫瘤免疫聯合療法臨床試驗。
HLX10-008-HCC201
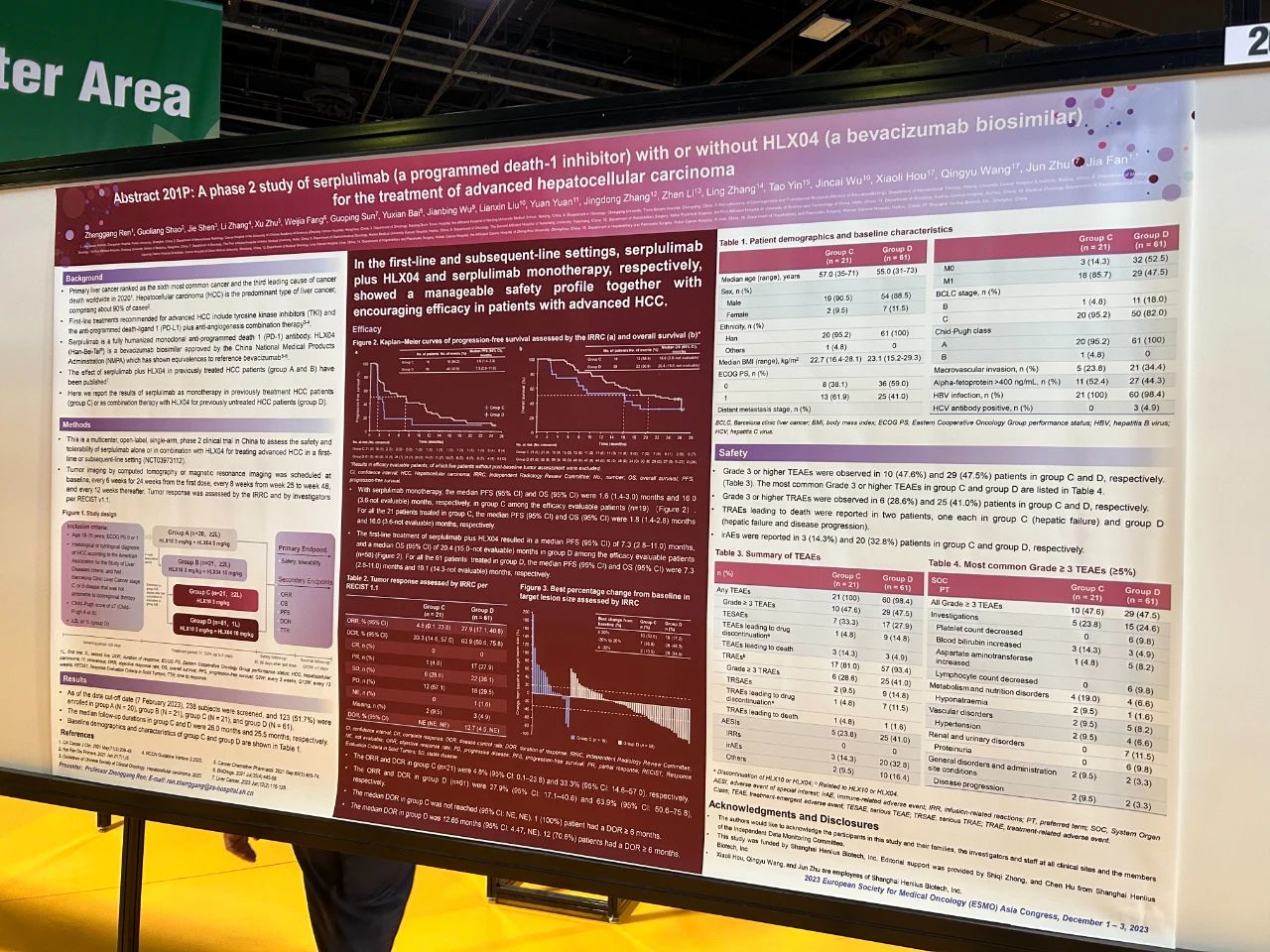
論文題目
一項斯魯利單抗(程序性死亡-1抑制劑)聯合或不聯合HLX04(貝伐珠單抗生物類似藥)治療晚期肝細胞癌II期研究
試驗設計
既往系統性治療失敗的晚期肝細胞癌患者接受斯魯利單抗3 mg/kg聯合HLX04 5 mg/kg(A組)、斯魯利單抗3 mg/kg聯合HLX04 10 mg/kg(B組)或斯魯利單抗3 mg/kg單藥治療(C組)。既往未接受過系統性治療的晚期HCC患者被納入D組,接受斯魯利單抗3 mg/kg聯合HLX04 10 mg/kg的治療。所有治療均採用靜脈輸注,每兩周一次。主要終點是安全性。
結果
這項開放標籤、多中心II期研究在中國進行;共28家醫院有患者入組。A組和B組的結果先前已發表;這裡我們展示了C組和D組的結果。截至2023年2月7日,C組和D組分別有21例和61例患者入組。中位隨訪時間分別為26.0個月和25.5個月。C組和D組分別有10(47.6%)例和29(47.5%)例患者報告了≥3級的治療期間出現的不良事件。C組有1(4.8%)例患者死於治療相關的肝衰竭;D組有1(1.6%)例患者死於治療相關的肝衰竭和疾病進展。C組經獨立影像評估委員會(IRRC)根據RECIST v1.1評估的客觀緩解率為4.8%(95%置信區間[CI] 0.1–23.8),D組為27.9%(95% CI 17.1–40.8)。C組和D組經IRRC評估的中位無進展生存期分別為1.8個月(95% CI 1.4–2.8)和7.3個月(95% CI 2.8–11.0)。C組和D組的中位總生存期分別為16.0個月(95% CI 3.6–無法評估[NE])和19.1個月(95% CI 14.3–NE)。
結論
斯魯利單抗聯合HLX04和斯魯利單抗單藥分別在晚期HCC患者的一線和後線治療中展現出可控的安全性和良好的療效。
創新型抗EGFR單抗HLX07
HLX07是復宏漢霖自主研發的針對EGFR靶點的創新型生物藥。基於公司成熟的抗體工程改造平台,復宏漢霖在西妥昔單抗的基礎上,通過將HLX07的Fab區人源化,同時使該產品聚糖含量降至最低,以具備更低的免疫原性和良好的靶點親和力。截至目前,復宏漢霖已就HLX07在中國、美國、歐盟、澳大利亞、日本等多個知識產權區獲得專利,並在中國和美國獲得臨床試驗許可。目前,公司圍繞食管鱗癌、鱗狀非小細胞肺癌、皮膚鱗癌等多個實體瘤適應症,正在積極開展HLX07單藥或聯合H藥 漢斯狀®(斯魯利單抗)的II期臨床探索。
HLX10HLX07-sqNSCLC-201
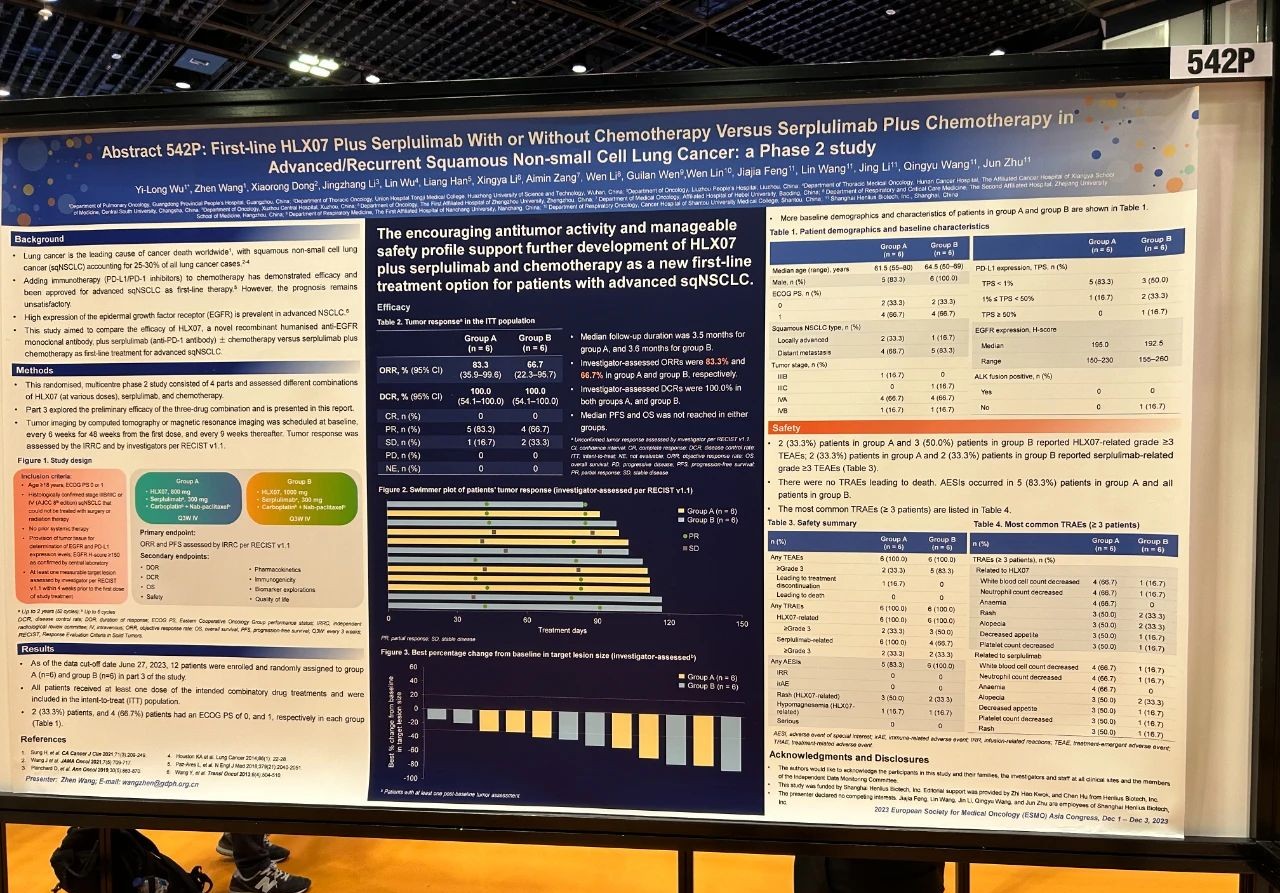
論文題目
HLX07聯合斯魯利單抗與/不與化療聯用對比斯魯利單抗聯合化療一線治療晚期/復發性鱗狀非小細胞肺癌:一項II期研究
試驗設計
這項隨機、多中II期研究由四個階段組成,旨在評估HLX07(不同劑量)、斯魯利單抗和化療的不同治療組合的效果。第三階段研究探索了三種藥物聯合治療的初步療效,其結果在下文中展示。研究納入不能手術或放療的、且之前未接受過系統性治療的IIIB/IIIC或IV期鱗狀非小細胞肺癌(sqNSCLC)患者,按1:1的比例隨機分組,給予800 mg(A組)或1000 mg(B組)的HLX07靜脈輸注,聯合300 mg的斯魯利單抗和化療(卡鉑-白蛋白紫杉醇),每三周一次。主要終點是IRRC根據RECIST 1.1評估的ORR和PFS。
結果
截至2023年6月27日,第三階段研究共入組12例患者並隨機分配至A組(6例)和B組(6例)。患者的中位年齡為64歲。11(91.7%)例患者為男性。10(83.3%)例患者的疾病分期為IV期。中位隨訪時間為3.5個月時,A組和B組經研究者根據RECIST 1.1評估的未確認的ORR分別為83.3%(95% CI 35.9–99.6)和66.7%(95% CI 22.3–95.7)。兩組的疾病控制率均為100.0%(95% CI 54.1–100.0)。A組的2(33.3%)例患者和B組的1(16.7%)例患者報告了嚴重的治療期間出現的不良事件(TEAE)。B組的1(16.7%)例患者發生了3級特別關注不良事件(AESI)痤瘡樣皮炎;未發生4–5級AESI。研究未報告導致死亡的TEAE。
結論
HLX07聯合斯魯利單抗和化療一線治療晚期sqNSCLC患者有着良好的抗腫瘤療效且安全性可控,值得進一步研究。
HLX07-CSCC201
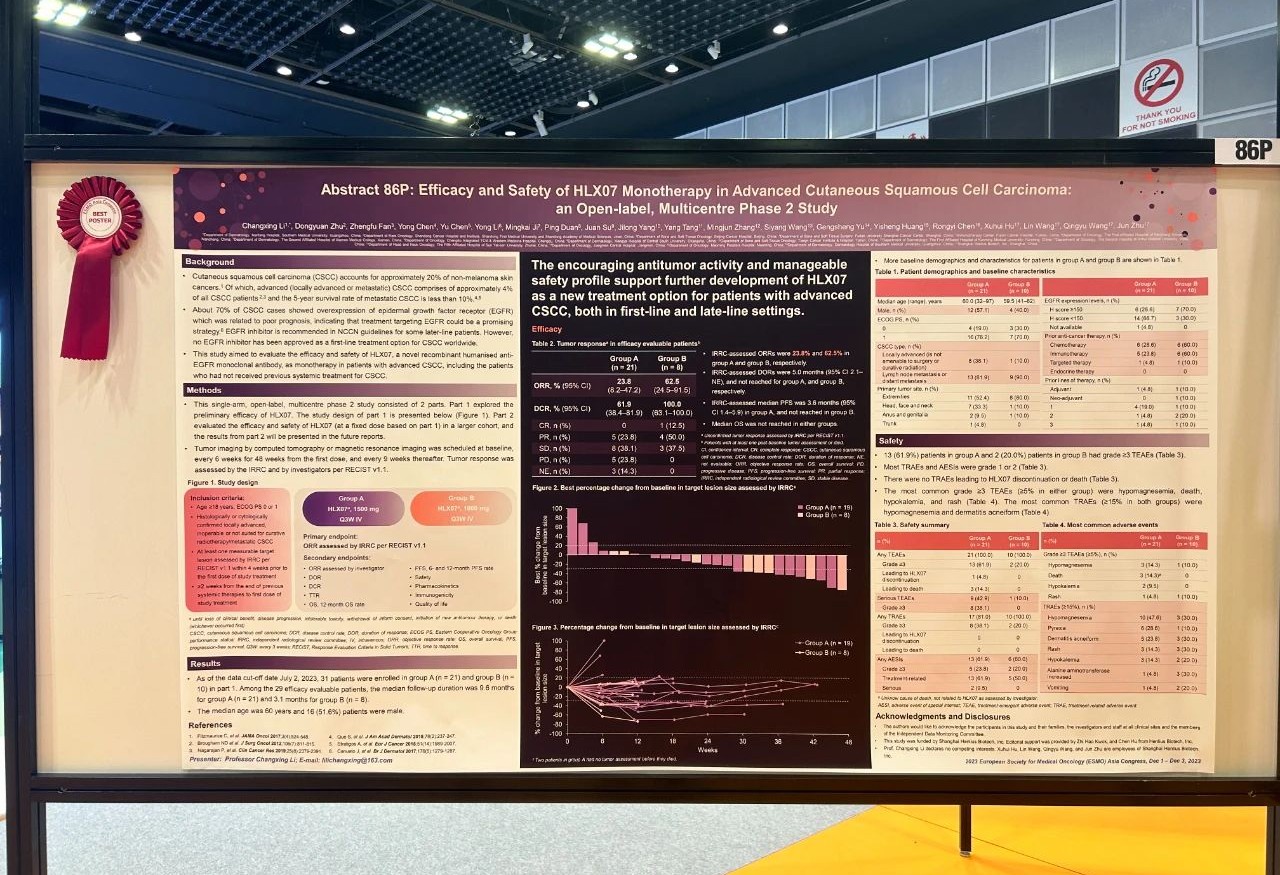
論文題目
HLX07單藥治療晚期皮膚鱗狀細胞癌的療效和安全性:一項開放標籤、多中心II期研究
試驗設計
這項單臂、開放標籤、多中II期研究分為兩個階段。第一階段探索了初步療效,其結果在下文中展示;第二階段在更大的人群中評估了HLX07(基於第一階段確定的固定劑量)的療效和安全性。試驗納入患有伴淋巴結轉移/遠端轉移的晚期CSCC或無法進行手術/無法進行根治性放療的局部晚期CSCC患者,在第一階段研究中接受1500 mg(A組)或1000 mg(B組)的HLX07靜脈輸注,每三周一次。主要終點是獨立影像評估委員會(IRRC)根據RECIST 1.1評估的客觀緩解率(ORR)。次要終點包括其他療效指標、安全性、藥代動力學特徵、免疫原性和生活質量評估。
結果
截至2023年7月2日,第一階段研究共入組31名患者,其中A組21例,B組10例。患者的中位年齡為60歲;16(51.6%)例患者為男性。在29例療效可評估的患者中(A組21例,B組8例),A組與B組的中位隨訪時間分別為9.6個月和3.1個月。A組和B組患者經IRRC評估的未確認的ORR分別為23.8%(95% CI 8.2–47.2)和62.5%(95% CI 24.5–91.5)。A組經IRRC評估的中位PFS為3.6個月(95% CI 1.4–5.9),B組的中位PFS未達到。中位OS在兩組患者中均未達到。在接受了研究治療的31例患者中,A組和B組分別有8(38.1%)例和2(20.0%)例患者發生了≥3級的治療相關不良事件(TRAE),最常見的是低鎂血症(14.3% vs. 10.0%)和皮疹(4.8% vs. 10.0%)。研究未報告導致死亡的TRAE。
結論
HLX07單藥治療對晚期CSCC患者有着良好的抗腫瘤療效和耐受性。
創新型抗LAG-3單抗HLX26
HLX26為復宏漢霖自主研發的靶向淋巴細胞活化基因3(lymphocyte-activation gene 3,LAG-3)胞外結構域的人源化單抗。通過阻斷LAG-3介導的負信號通路,HLX26可使T細胞重新獲得細胞毒性活性,從而恢復對腫瘤的殺傷功能。臨床前研究表明,HLX26具有抗腫瘤活性以及良好的耐受性和安全性,尤其在臨床前體外實驗和動物模型中,H藥與HLX26聯用顯示出了明顯的腫瘤抑制協同效應,為兩種產品的聯合應用提供了科學依據,有力支持後續臨床研究的開展。目前,H藥聯合HLX26雙免疫治療轉移性結直腸癌(mCRC)的II期臨床試驗,及其一線治療晚期非小細胞肺癌(NSCLC)的II期臨床試驗已相繼完成首例患者給藥。
HLX26-002
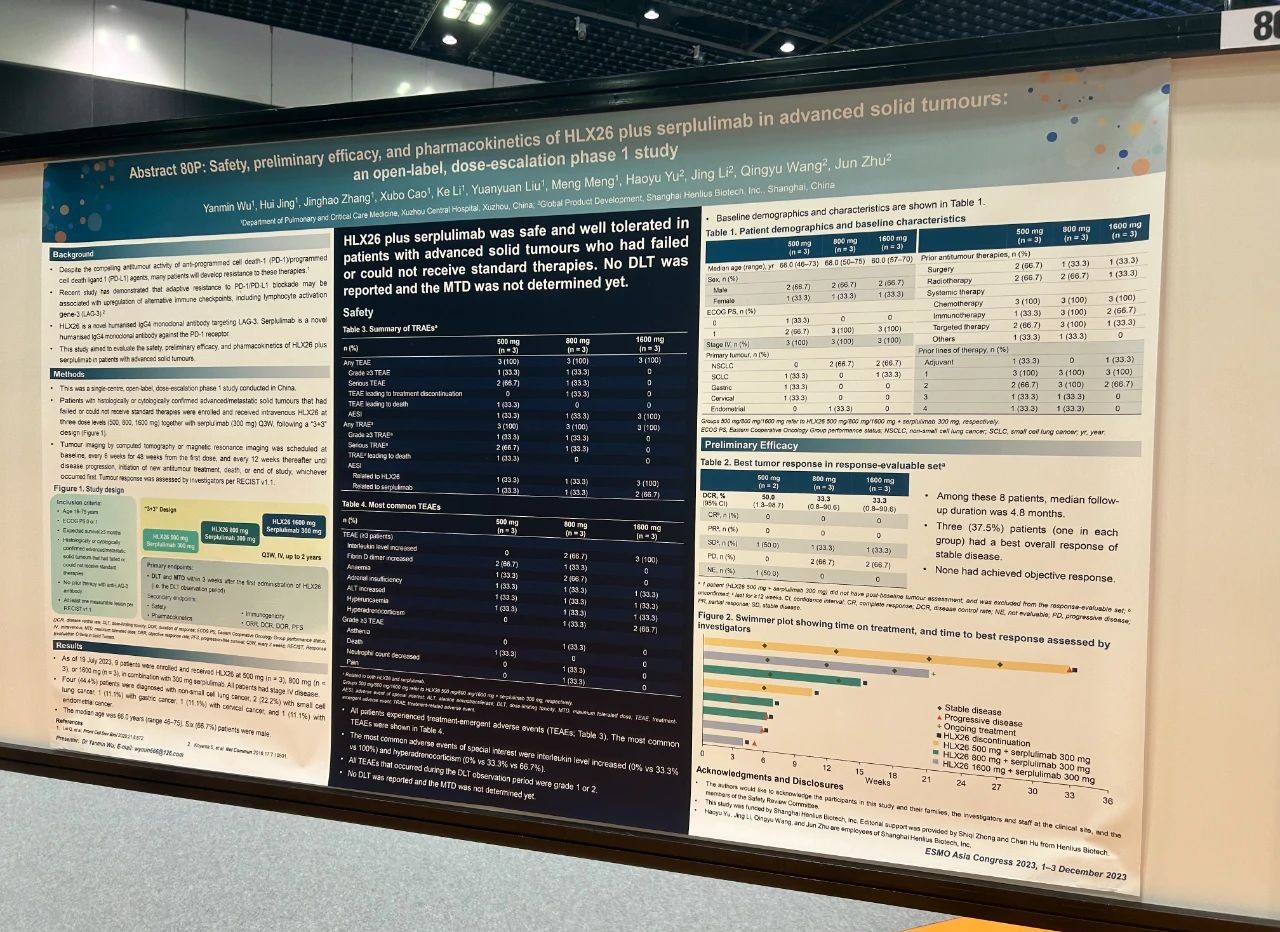
論文題目
HLX26聯合斯魯利單抗治療晚期實體瘤的安全性、初步療效和藥代動力學特徵:一項開放標籤、劑量遞增的I期研究
試驗設計
這是一項單中心、開放標籤、劑量遞增的I期研究。研究納入組織學或細胞學確診的經標準治療失敗或無法獲得標準治療的晚期/轉移性實體瘤患者,採用「3+3」設計,給予患者三種劑量水平的HLX26(500、800、1600 mg)聯合斯魯利單抗(300 mg)的靜脈輸注,每三周一次。主要終點是HLX26首次給藥後3周內(即劑量限制性毒性[DLT]觀察期)的DLT和最大耐受劑量(MTD)。次要終點包括安全性、初步療效、藥代動力學特徵和免疫原性。
結果
截至2023年7月19日,9例患有原發性IV期非小細胞肺癌(n=4,44.4%)、小細胞肺癌(n=2,22.2%)、胃癌(n=1,11.1%)、宮頸癌(n=1,11.1%)或子宮內膜癌(n=1,11.1%)的患者入組,並接受了500 mg(n=3)、800 mg(n=3)或1600 mg(n=3)的HLX26聯合300 mg的斯魯利單抗治療。患者的中位年齡為66歲,6(66.7%)例患者為男性。治療期間所有患者均發生了不良事件(TEAE);在DLT觀察期內發生的所有TEAE均為1級或2級。800 mg組的一例患者報告了3級或4級藥物相關的乏力、疼痛和中性粒細胞計數降低。研究未報告DLT,MTD尚未確定。在8例療效可評估的患者中,無人達到完全或部分緩解;3(37.5%)例患者(每組各1例)的最佳總緩解為疾病穩定。
結論
不同劑量的HLX26聯合斯魯利單抗治療未出現新的安全性信號。HLX26聯合斯魯利單抗在經標準治療失敗或無法獲得標準治療的晚期/轉移性實體瘤患者中是安全且耐受性良好的。
