近日,復宏漢霖(2696.HK)宣布,公司創新型BRAFV600E小分子抑制劑HLX208用於治療BRAFV600E突變的成人朗格漢斯細胞組織細胞增生症(Langerhans cell histiocytosis,LCH)和Erdheim-Chester病(Erdheim-Chester disease,ECD)的II期臨床研究(HLX208-LCH/ECD201)結果入選歐洲腫瘤學會亞洲分會(ESMO Asia)年會,以簡短口頭報告形式展示更新的數據。該研究由中國醫學科學院北京協和醫學院附屬北京協和醫院李劍教授牽頭開展,試驗結果首次發布於2023 ASCO年會。

目前ECD與LCH均被認為屬於炎性髓系腫瘤,嚴重影響患者生存質量,已被中國國家衛生健康委員會(衛健委)納入《第一批罕見病目錄》[1]。根據衛健委發布的《罕見病診療指南2019年版》[2],LCH與ECD的主要特徵為MAPK/ERK信號通路激活,均存在超過50%的BRAFV600E基因突變率,所以 BRAFV600E是這兩種罕見病的重要治療靶點。HLX208具有全新的化學母核結構,是公司從潤新生物引進的具備「同類最佳」潛力的BRAFV600E小分子抑制劑。臨床前研究結果表明,HLX208具有單一穩定晶型,良好的口服生物利用度及顯著的腫瘤抑制活性。早期臨床研究也展現出HLX208具有良好的安全性、耐受性和有效性。2023年4月,HLX208被正式納入突破性治療品種名單,用於治療BRAFV600E突變的LCH和ECD。
此次ESMO Asia年會上公布的數據詳情如下:
論文題目
創新型BRAF V600E抑制劑HLX208在攜帶BRAF V600E突變的朗格漢斯細胞組織細胞增生症和/或Erdheim-Chester病成年患者中的應用
試驗設計
在這項單臂、開放標籤、多中心的Ⅱ期研究中,組織學確診的朗格漢斯細胞組織細胞增生症(LCH)和/或Erdheim-Chester病(ECD)患者被納入並給予每天兩次口服HLX208 450 mg,以28天為一個周期。主要終點是由獨立影像評估委員會(IRRC)根據實體瘤療效PET評價標準(PERCIST)1.0評估的ORR。次要終點包括安全性、其他療效指標以及HLX208的藥代動力學特徵。
結果
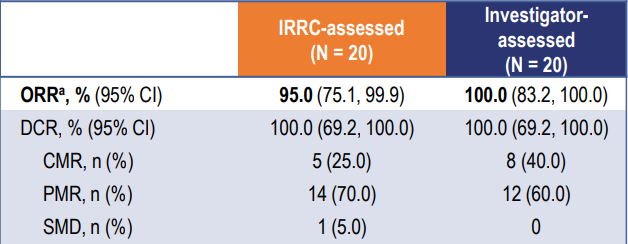
截至2023年7月14日,共有30例患者入組。患者的中位年齡為38.5歲;13(43.3%)例患者為男性。19(63.3%)例患者被診斷為LCH,10(33.3%)例被診斷為ECD,1(3.3%)例為LCH合併ECD。8(26.7%)例患者為單系統多病灶病變,22(73.3%)例為多系統病變。中位隨訪時間為10.7個月。在20例療效可評估的患者中,IRRC根據PERCIST 1.0評估的未確認的ORR為95.0%(95% CI 75.1–99.9%)。腫瘤緩解的詳細結果見表1。在接受HLX208治療的30例患者中,有5(16.7%)例報告了3–4級治療相關不良事件,最常見的是丙氨酸氨基轉移酶升高(6.7%)和天門冬氨酸氨基轉移酶升高(6.7%)。治療期間未見導致死亡的不良事件。
表1 根據PERCIST 1.0評估的腫瘤緩解(未確認)
結論
HLX208對攜帶BRAFV600E突變的LCH和/或ECD成年患者具有良好的療效,且安全性可控。
