2023年10月27日,復宏漢霖(2696.HK)宣布,基於與宜聯生物的合作,公司開發的兩款抗體偶聯藥物(antibody-drug-conjugate, ADC)——靶向表皮生長因子受體(EGFR)的新型ADC候選藥物注射用HLX42,及靶向程序性死亡-配體1(PD-L1)的新型ADC候選藥物注射用HLX43,已經同步獲得國家藥品監督管理局(NMPA)臨床試驗批准,擬用於晚期/轉移性實體瘤的治療。這是復宏漢霖首批步入臨床開發階段的ADC創新藥。目前針對PD-L1靶點開發的ADC產品較少,HLX43是國內首個進入臨床階段的靶向PD-L1的 ADC產品。此外,公司管線中多款ADC/AXC候選藥物正處於臨床前開發階段。

EGFR靶向ADC候選藥HLX42
EGFR屬於受體酪氨酸激酶,在細胞增殖、分化和遷移的過程中發揮重要作用。研究發現,與正常組織相比,EGFR的突變或者高表達與非小細胞肺癌、結腸癌等腫瘤的發生密切相關,是抗腫瘤藥物開發中的重要靶點[1]。儘管多款EGFR抗體和第三代EGFR受體酪氨酸激酶抑制劑(TKI)已經在腫瘤治療中獲得了廣泛成功,但對於因耐藥而導致的標準治療失敗或治療後復發的腫瘤患者,仍存在未滿足的臨床需求[2]。近年來,隨着ADC技術的快速發展,ADC藥物的開發為腫瘤患者提供了新的治療方案[3],靶向EGFR的ADC藥物有望克服現有靶向EGFR治療的耐藥機制,為更多晚期非小細胞肺癌、結直腸癌等患者帶來臨床獲益。
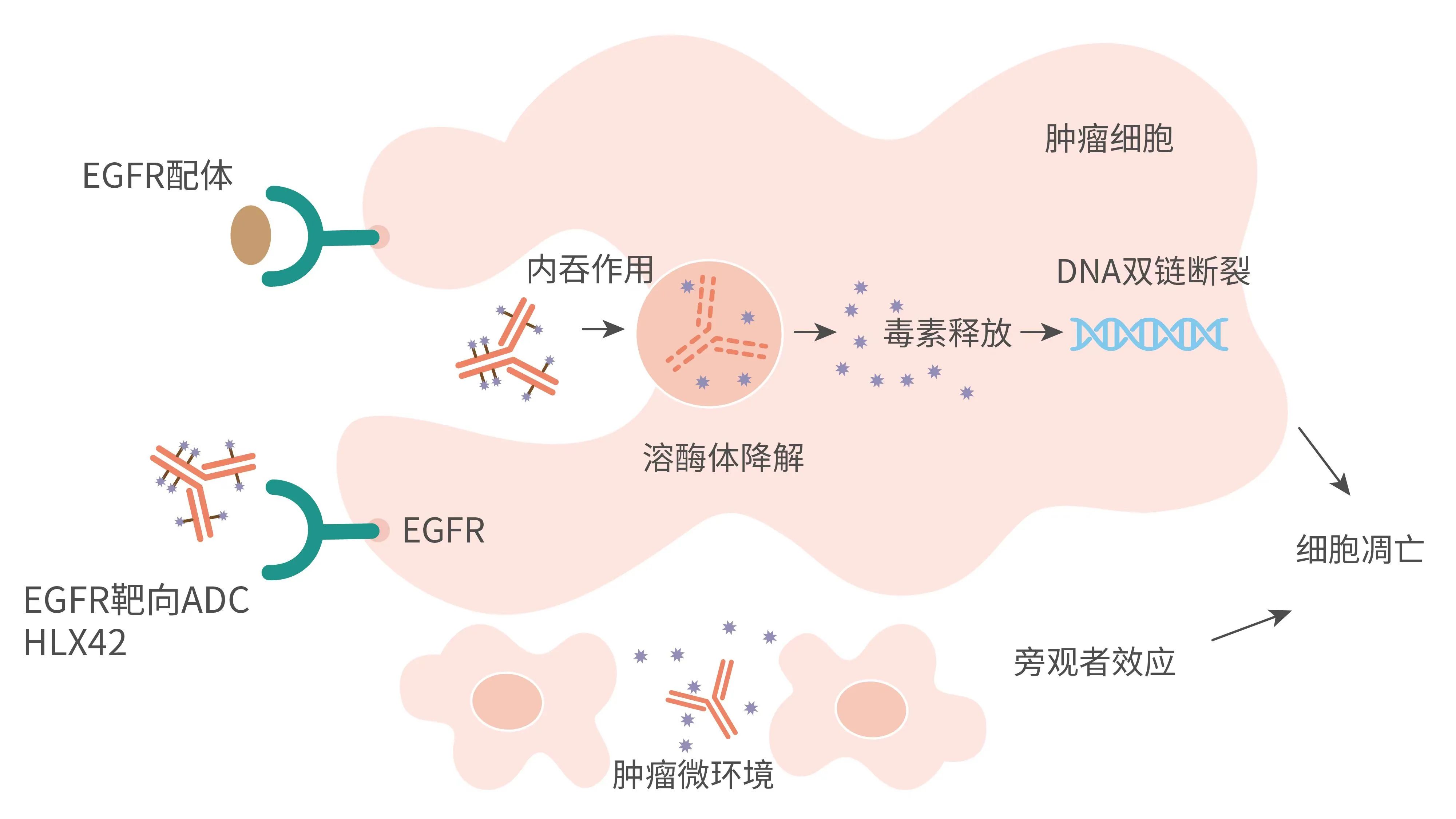
HLX42由高度特異性的人源化lgG1 EGFR抗體分子、可裂解的新型連接子-荷載毒素偶聯製備而成,其藥物抗體比(drug-to-antibody ratio, DAR)約為8。其中,HLX42的荷載毒素為一種新型DNA拓撲異構酶I(Topoisomerase I)小分子抑制劑,通過造成DNA雙鏈斷裂,阻斷DNA複製,從而導致腫瘤細胞凋亡。靜脈輸注後,HLX42的連接子-毒素能夠在腫瘤微環境中特異性裂解釋放,具備較強的旁觀者殺傷效應,獨特的作用機制使得HLX42較同類ADC產品具有更大的治療窗口,增強ADC在實體腫瘤中的治療效果。
PD-L1靶向ADC候選藥HLX43
程序性死亡-配體1(PD-L1)是一類跨膜蛋白,是免疫反應中重要的負性調控因子,可通過與程序死亡受體1(PD-1)結合啟動T細胞程序性死亡,使腫瘤細胞獲得免疫逃逸[4]。近年來以抗PD-1/L1抗體為代表的免疫檢查點抑制劑促進了腫瘤免疫治療的高速發展,成為腫瘤患者各線治療的主要手段之一。然而,部分PD-L1陽性患者對該療法無響應,或者出現耐藥[5]。鑑於PD-L1在非小細胞肺癌、結直腸癌、三陰性乳腺癌、鱗狀細胞癌等多種癌種中均有表達,且在正常組織中的表達有限,因此PD-L1在作為免疫檢查點之外,還具備開發PD-L1靶向ADC藥物的潛力,有望為無法從PD-1/L1免疫治療中獲益的患者帶來有效的治療方案[6]。
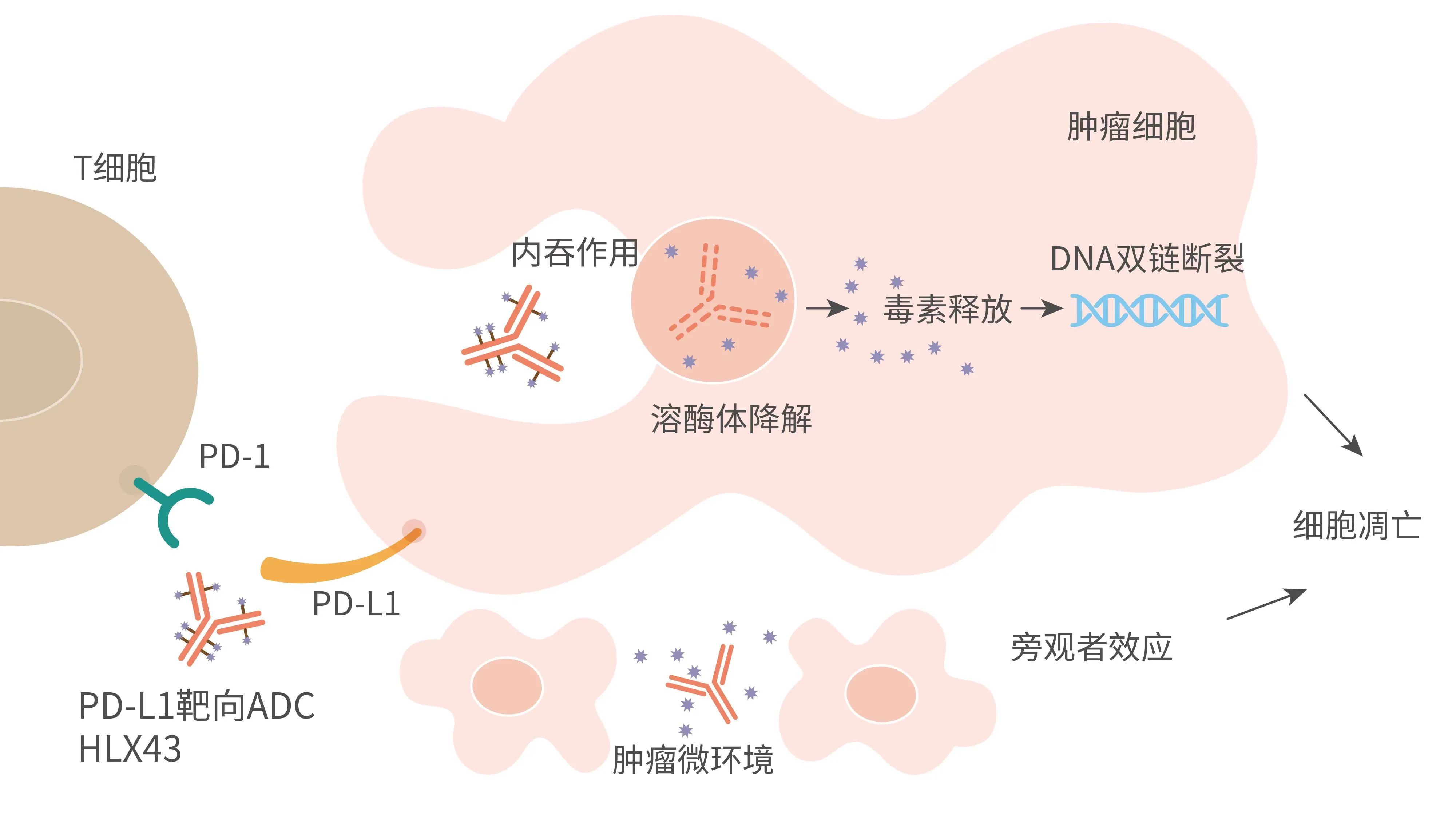
HLX43由高度特異性的人源化lgG1 PD-L1抗體分子、可裂解的新型連接子-荷載毒素偶聯製備而成,其藥物抗體比(drug-to-antibody ratio, DAR)約為8。其中,HLX43的荷載毒素為一種新型DNA拓撲異構酶I(Topoisomerase I)小分子抑制劑,通過造成DNA雙鏈斷裂,阻斷DNA複製,從而導致腫瘤細胞凋亡。靜脈輸注後,HLX43的連接子-毒素能夠在腫瘤微環境中特異性裂解釋放,具備較強的旁觀者殺傷效應,獨特的作用機制使得HLX43較同類ADC產品具有更大的治療窗口,增強ADC在實體腫瘤中的治療效果。
兼具抗體分子的高度靶向性和細胞毒素的強大殺傷力,HLX42、HLX43已經在非臨床藥理學研究、藥代動力學研究及安全性評價中展現出良好的抗腫瘤活性和安全性。在第三代EGFR TKI(奧希替尼)或EGFR單克隆抗體(西妥昔單抗)耐藥的非小細胞肺癌及結直腸癌腫瘤模型中,HLX42顯示出腫瘤殺傷效果。在抗PD-1單抗耐藥的非小細胞肺癌、結直腸癌、三陰性乳腺癌、鱗狀細胞癌等腫瘤模型中,HLX43顯示出良好的腫瘤殺傷效果。值得一提的是,HLX42及HLX43的臨床前研究數據同步入選了2023歐洲腫瘤內科學會(ESMO)大會,以壁報形式進行展示。復宏漢霖也計劃啟動相應的I期臨床研究,以評估HLX42/HLX43在晚期/轉移性實體瘤患者中的安全性、耐受性及藥代動力學特徵
未來,復宏漢霖將持續立足於未滿足的臨床需求,充分發揮公司在抗體藥物和抗體偶聯藥物領域的一體化平台優勢,積極探索新靶點、新機制,不斷拓展疾病領域和新分子類型,為全球患者帶來更多高質量、可負擔的創新治療方案。
參考文獻
[1] Ni cholson, Robert Ian, Julia Margaret Wendy Gee, and Maureen Elaine Harper. EGFR and cancer prognosis. European journal of cancer 37 (2001): 9-15.
[2] Tan, Chee Seng, D. Gilligan, and S. Pacey. Treatment approaches for EGFR-inhibitor-resistant patients with non-small-cell lung cancer. The Lancet Oncology 16.9(2015): e447-59.
[3] Ponziani S, Di Vittorio G, Pitari G, et al. Antibody-Drug Conjugates: The New Frontier of Chemotherapy. Int J Mol Sci. 2020 Jul 31;21(15):5510.
[4] Han Y, Liu D, Li L. PD-1/PD-L1 pathway: current researches in cancer[J]. American Journal of Cancer Research, 2020, 10(3):727-742.
[5] Attili I, Tarantino P, Passaro A, et al. Strategies to overcome resistance to immune checkpoint blockade in lung cancer[J]. Lung cancer: Journal of the International Association for the Study of Lung Cancer, 2021(154-):154.
[6] Kwan B, Ramirez M, Jin S, et al. 783 SGN-PDL1V, a novel, investigational PD-L1-directed antibody-drug conjugate for the treatment of solid tumors[J]. 2021.
