01 脂質體納米顆粒(LNP)
磷脂在水性溶劑中易呈現封閉的雙分子層,形成納米尺度(20-200 nm)的顆粒,即脂質體納米顆粒。LNP由陽離子脂質、膽固醇、輔助磷脂和聚乙二醇化磷脂四部分組成,其中陽離子脂質包含帶銨根的親水端,可在酸性環境中結合氫離子帶正電,通過靜電吸附作用將藥物分子包括在LNP中。在LNP被細胞內吞進入內含體後,陽離子脂質可發生電離,破壞內含體膜以實現藥物分子逃逸。在靜脈注射後,LNP傾向於在肝臟積聚。通過在LNP表面修飾特異性配體,有望調控藥物分子的靶向遞送。

Physiological barriers for lipid nanoparticle–mRNA (LNP–mRNA) formulations post systemic and local delivery. [2]
更有趣的是,研究發現,通過調整脂質的成分也可以將藥物精準遞送到靶向位點。比如,美國德州大學西南醫學中心的Daniel J. Siegwart課題組發現[3],通過添加稱為「SORT」(selective organ targeting)分子的成分,可調控LNP在體內的器官靶向特性,實現除肝臟外對肺部、腎臟、脾臟甚至上皮和免疫細胞的靶向遞送。
脂質體製劑最早在1995年即被FDA批准用於多柔比星的遞送,自此脂質體載體一直處於發展中,直到在新冠疫情中LNP在mRNA疫苗研究中大放異彩,脂質體載體才站在遞送技術研究的風頭浪尖上。作為核酸藥物遞送的理想載體,LNP不僅在mRNA,也在反義寡核苷酸(ASO)和siRNA遞送中佔據重要地位。隨着LNP靶向遞送技術的不斷進步,以及核酸藥物關注度的提高,LNP無疑是未來藥物遞送載體的重要組成部分。
02 N-乙酰半乳糖胺(GalNAc)技術
GalNAc技術是一種基於特定化學修飾的靶向遞送技術,主要用於小核酸藥物。其原理是,GalNAc對於去唾液酸糖蛋白(ASGPR)有高親和性,ASGPR主要表達在肝實質細胞表面。因此,通過在小核酸分子上偶聯GalNAc,有助於其靶向結合在肝細胞上,隨後在內吞作用下GalNAc核酸偶聯物被肝細胞攝取,實現高度的肝靶向特異性遞送。
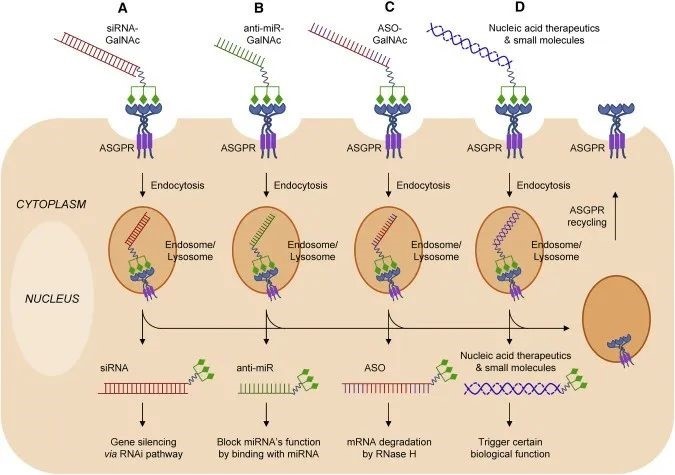
GalNAc/ASGPR-Mediated Oligonucleotide Delivery to Hepatocytes[4]
GalNAc遞送技術已應用於多種肝靶向核酸藥物的遞送,其優勢包括可通過皮下注射給藥、作用時效長、肝靶向特異性強、毒副作用小等。該方法目前僅在小核酸藥物尤其是siRNA的遞送上有用武之地,並且由於ASGPR表達僅限於肝實質細胞表面,因此,該方法的器官靶向特異性受到嚴格限制。但這不妨礙GalNAc技術在核酸藥物的遞送上扮演關鍵角色。
03 外泌體(exosome)
外泌體來源於內含體,是由多泡體(MVB)與細胞膜融合後釋放到胞外的膜狀囊泡小體,直徑在40-120 nm之間。作為內源性的納米載體,外泌體免疫原性較低,安全性高。外泌體具有磷脂雙分子層結構,在外泌體表面分佈有多肽,可設計為與靶細胞上受體特異性結合,從而加速外泌體在靶標位點的富集。在體內,外泌體在細胞遠程通訊中扮演重要角色,其可以通過體內循環穿梭於細胞和組織之間,甚至具有可穿越屏障,包括細胞質膜、血腦屏障等的特性。穿過血腦屏障意味着外泌體可進行中樞神經系統的給藥研究,有望用於帕金森疾病、惡性膠質瘤等疑難疾病的臨床試驗中。此外,外泌體具有親水性內核,能有效裝載可溶藥物,包括核酸、脂質、小分子、重組蛋白等。
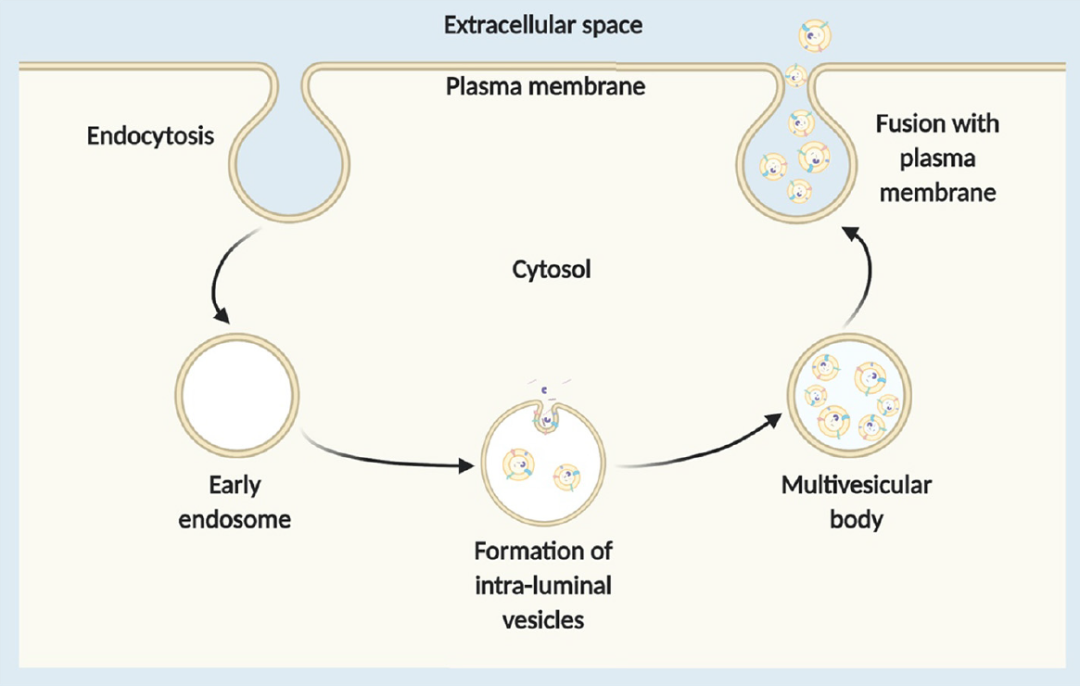
Exosome formation and release from the endosomal pathway[5]
外泌體的應用存在諸多限制,其中關鍵問題如外泌體的產量尚未滿足工業化要求。一般哺乳動物細胞產生的外泌體數量較低,並且外泌體的純化存在困難。但考慮到外泌體誘人的應用前景,對外泌體的轉化研究一直是領域中的熱點。比如,一些公司開發了可對外泌體進行工程化改造的技術平台,以實現靶向性的藥物遞送。
04 核酸納米載體
核酸納米載體是指以核酸分子(DNA或RNA)為材料,通過設計核酸序列指導核酸分子自組裝為二維或三維的納米結構,作為藥物遞送載體的技術。
由於核酸分子的免疫原性低、可設計性強、化學可修飾性強、自身可成藥等優點,核酸納米載體在前沿研究領域廣受關注。理論上說,任何藥物分子只要和核酸能夠偶聯,即可採用核酸納米載體進行遞送,包括小分子、蛋白質、多肽等。尤其是在核酸藥物的遞送中,核酸納米載體更具有得天獨厚的優勢。核酸自組裝結構一般包括DNA瓦塊和DNA摺紙,前者由短鏈相互雜交而成,後者由數百條短鏈輔助摺疊一條長鏈形成[6]。由於空間大、產率高且易於設計,DNA摺紙已被廣泛用於小分子或大分子藥物的遞送研究。此外,通過設計DNA摺紙的形狀也能對細胞內吞進行有效調控。目前,DNA摺紙藥物遞送的研究主要集中在化療藥物、核酸藥物上,通過在摺紙上修飾適配體或葉酸分子等,用於腫瘤等疾病的研究。
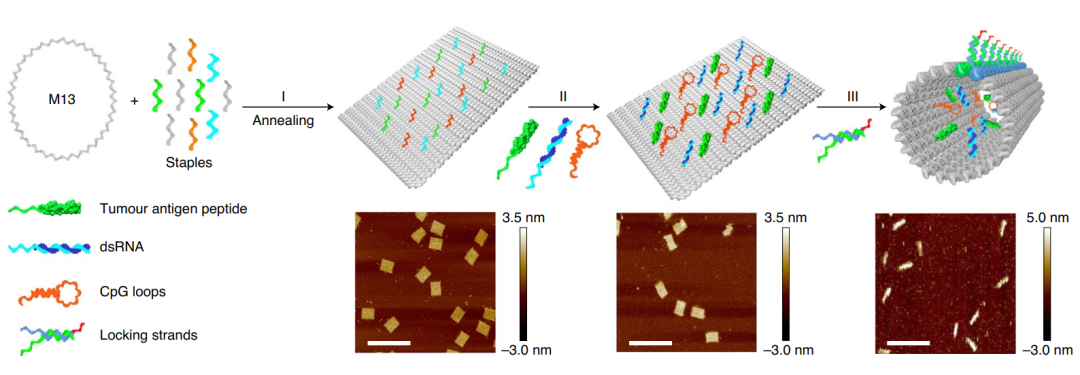
Schematic illustration of the construction of the tumour antigen peptide/CpG loop/dsRNA-co-loaded robotic nanostructure by DNA origami [7]
值得注意的是,除了自組裝納米載體外,球形核酸,即將核酸分子組裝在納米粒子表面形成的三維球狀結構,同樣在藥物遞送領域得到了應用,其在臨床研究上的進展甚至超過了自組裝納米載體。球形核酸發明人Mirkin教授創建的公司已開展了針對惡性膠質瘤的臨床實驗,採用球形核酸形式的核酸藥物跨越血腦屏障,用於腫瘤治療[8]。未來,核酸納米載體憑藉豐富的應用場景和可控性強的特點,具有不可估量的市場前景。
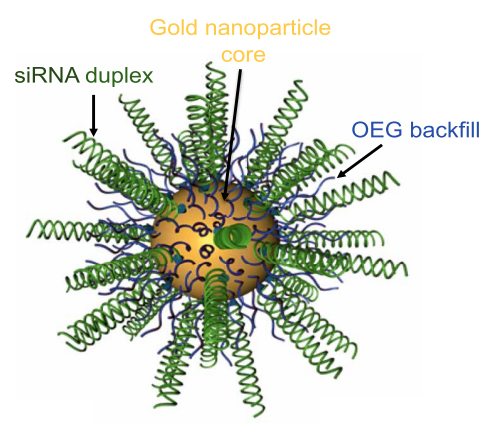
Schematic of NU-0129, a Bcl2L12-targeting, siRNA-based SNA (spherical nucleic acid) [8]
參考文獻
[1] A. M. Vargason, A. C. Anselmo, S. Mitragotri, Nature Biomedical Engineering 2021, 5, 951-967
[2] Hou, Xucheng, et al. "Lipid nanoparticles for mRNA delivery." Nature Reviews Materials 6.12 (2021): 1078-1094.
[3] Q. Cheng, T. Wei, L. Farbiak, L. T. Johnson, S. A. Dilliard, D. J. Siegwart, Nat Nanotechnol 2020.
[4] Huang, Yuanyu. "Preclinical and clinical advances of GalNAc-decorated nucleic acid therapeutics." Molecular Therapy-Nucleic Acids 6 (2017: 116-132.
[5] Wang, Jin, Derek Chen, and Emmanuel A. Ho. "Challenges in the development and establishment of exosome-based drug delivery systems." Journal of Controlled Release 329 (2021): 894-906.
[6] N. C. Seeman, Nature 2003, 421, 427-431.
[7] S. Liu, Q. Jiang, X. Zhao, R. Zhao, Y. Wang, Y. Wang, J. Liu, Y. Shang, S. Zhao, T. Wu, A DNA nanodevice-based vaccine for cancer immunotherapy, Nat. Mater. 20 (2021) 421–430.
[8] Kumthekar, Priya, et al. "A first-in-human phase 0 clinical study of RNA interference–based spherical nucleic acids in patients with recurrent glioblastoma." Science translational medicine 13.584 (2021): eabb3945.
我們希望參與這個項目的你
來自全球生命科學領域的頂尖高校、科研院所的博士後、博士、碩士研究生;
一位「頂天立地」的科研工作者 「頂天」 - 有敢想敢做向上攀登科研高峰的衝勁,「立地」 - 有腳踏實地、目標導向,能將科研設想變為現實的能力及態度。
項目徵集要求
個人簡歷(格式不限)
項目計劃書(格式不限)
報名流程及時間
報名及諮詢入口
如有問詢請聯繫:
