2022年7月6日,復宏漢霖(2696.HK)宣佈,公司自主開發的HLX301(重組抗PD-L1與抗TIGIT雙特異性抗體)用於局部晚期/轉移性實體瘤或淋巴瘤治療的I/II期臨床研究於中國完成首例受試者給藥。目前,全球範圍內尚無同類靶向PD-1/L1和TIGIT的雙特異性抗體獲批上市,HLX301有望成為first-in-class抗PD-L1×TIGIT雙抗。
含免疫球蛋白和ITIM結構域的T細胞免疫受體(T cell immunoglobulin and ITIM domain,TIGIT)是一種抑制性受體,在淋巴細胞中表達,包括自然殺傷(NK)細胞、活化的CD8+ T和CD4+ T細胞以及Treg(調節性T細胞)等,其重要配體為主要表達於APC(抗原提呈細胞)或腫瘤細胞表面的CD155(脊髓灰質炎病毒受體,PVR)[1-2]。作為免疫檢查點蛋白,TIGIT可通過多種作用機制抑制固有和適應性免疫,在腫瘤免疫抑制中的「踩剎車」作用和PD-1/PD-L1類似[3]。
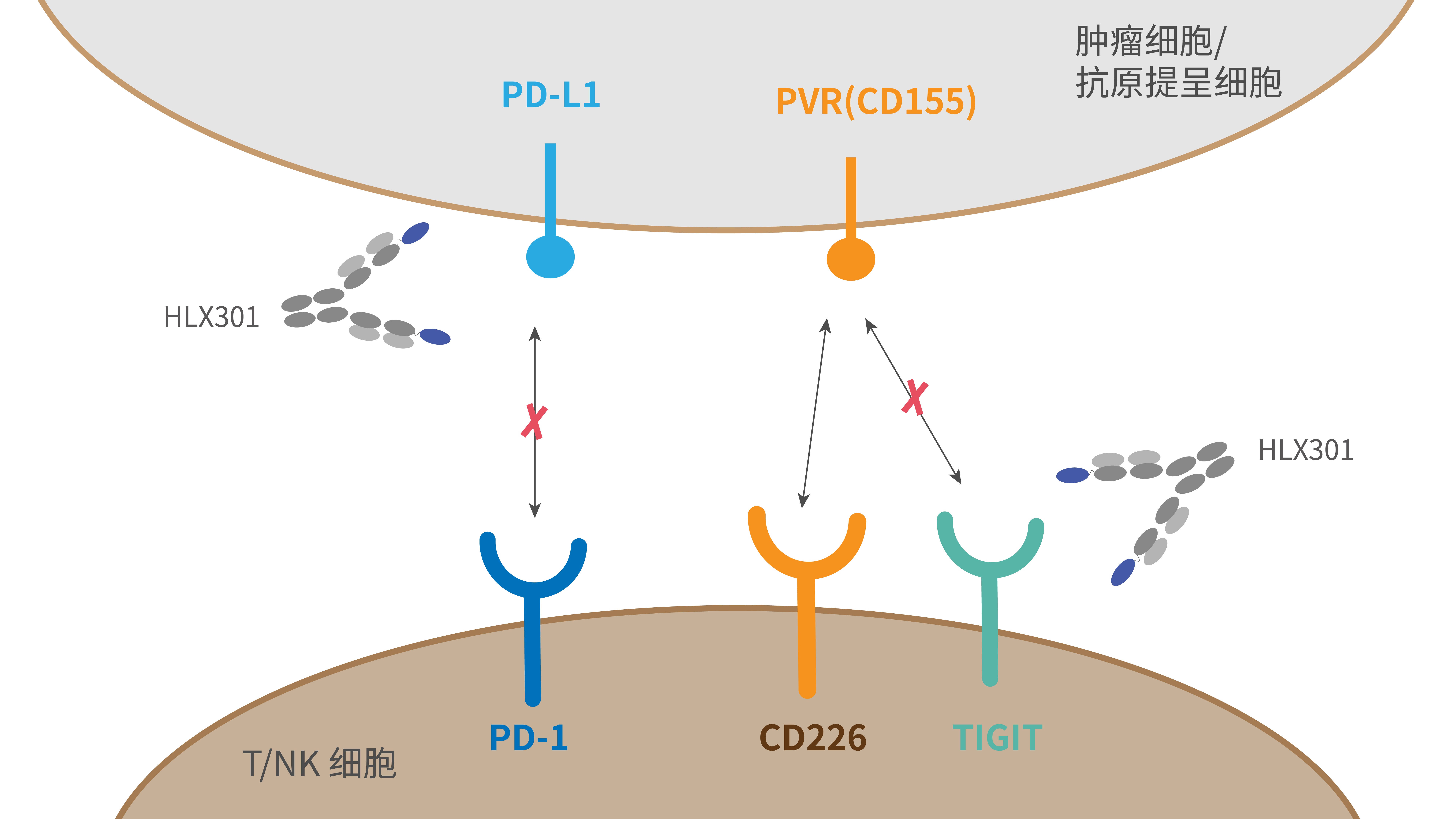
HLX301為復宏漢霖自主開發的創新型抗PD-L1與抗TIGIT雙特異性抗體,其TIGIT結合域來源於公司人源化羊駝重鏈可變區單域抗體(VHH)噬菌體展示庫篩選的對TIGIT具有高親和力、高特異性的VHH,通過重組技術與抗PD-L1單抗組合。HLX301可與PD-L1和TIGIT特異性結合併同時阻斷PD-1/PD-L1和TIGIT/PVR負向信號通路,抑制腫瘤細胞的生長,有望用於多種晚期腫瘤的治療,包括非小細胞肺癌、頭頸部鱗狀細胞癌、食管鱗癌等。臨床前研究結果表明,對比抗PD-L1單抗、抗TIGIT單抗以及兩種單抗的聯合療法,HLX301可更有效恢復T細胞受體下游信號,提高抗腫瘤活性,且耐受性、安全性良好,體現出雙抗療法的協同增強效應,為後續臨床研究的開展提供了科學基礎。2022年2月,HLX301在澳大利亞用於局部晚期或轉移性實體瘤治療的I期臨床研究完成首例受試者給藥。3月,該產品用於晚期腫瘤治療的I期臨床試驗申請獲國家藥品監督管理局批准。
復宏漢霖不斷深耕未滿足的臨床需求,目前已打造出多元化的創新產品管線,在PD-1/L1、LAG-3、TIGIT、BRAF等創新靶點全面佈局,以抗體技術為核心,積極開展雙特異性抗體、抗體偶聯藥物(ADC)、融合蛋白等多種藥物形式產品的開發。復宏漢霖將不斷提高創新效率,早日為全球患者帶來更多高質量、可負擔的創新治療方案。
關於該HLX301 I/II期臨床研究
本研究是一項開放標籤、多中心的I/II期臨床試驗,旨在評估HLX301在局部晚期/轉移性實體瘤或淋巴瘤患者中的安全性、耐受性、藥代動力學及初步抗腫瘤療效。本研究分為三個部分:Ia期劑量遞增階段、Ib期劑量擴展階段、II期臨床擴展階段。合格的受試者將接受每兩周靜脈輸注單藥HLX301的治療。Ia期通過貝葉斯最優區間(BOIN)設計,研究HLX301的安全性並確定劑量限制性毒性(DLT)和最大耐受劑量(MTD)。Ib期將進一步評估HLX301的藥代動力學、藥效動力學特徵及初步療效,以確定II期臨床試驗推薦劑量(RP2D)。II期研究的主要目的為評估HLX301在局部晚期/轉移性實體瘤或淋巴瘤患者中的療效,主要終點為研究者評估的客觀緩解率(ORR)、疾病控制率(DCR)和緩解持續時間(DOR),次要目的為確認HLX301的安全性並評估PD-L1表達水平與HLX301抗腫瘤活性之間的關係。
參考文獻
[1] Chauvin JM, Zarour HM. TIGIT in cancer immunotherapy. J Immunother Cancer. 2020;8(2).
[2] Sanchez-Correa B, Valhondo I, Hassouneh F, et al. DNAM-1 and the TIGIT/PVRIG/TACTILE Axis: Novel Immune Checkpoints for Natural Killer Cell-Based Cancer Immunotherapy. Cancers (Basel). 2019;11(6):877.
[3] Yue C, Gao S, Li S, Xing Z, Qian H, Hu Y, Wang W and Hua C (2022) TIGIT as a Promising Therapeutic Target in Autoimmune Diseases. Front. Immunol. 13:911919.
