2022年6月6日,復宏漢霖(2696.HK)宣佈,公司首個創新型單抗H藥 漢斯狀®(斯魯利單抗)針對微衛星高度不穩定或錯配修復缺陷(MSI-H/dMMR)實體瘤的關鍵性註冊II期臨床研究(ASTRUM-010)再次入選ASCO年會,數據更新將以海報形式展示。研究由中國人民解放軍東部戰區總醫院秦淮醫療區秦叔逵教授和上海東方醫院李進教授共同牽頭開展。基於該試驗結果,H藥已正式獲批用於治療微衛星高度不穩定(MSI-H)實體瘤,以「泛癌種」治療惠及廣大實體瘤患者。
據統計,中國每年新發MSI-H腫瘤患者逾30萬,MSI-H常見於子宮內膜癌、結直腸癌、胃癌等癌症,此類患者通常對於免疫檢查點抑制劑有較高的應答率,PD-1/PD-L1作為重要的免疫抑制分子對於MSI-H特徵型實體瘤患者具有較好的治療效果。復宏漢霖就這一適應症開展的ASTRUM-010臨床試驗其結果曾分別於2021年ASCO年會、2021年CSCO年會上發佈,此次ASCO年會上公佈的該研究更新數據結果如下:
論文題目
創新型抗PD-1抗體斯魯利單抗在經治療、不可切除或轉移性MSI-H/dMMR實體瘤患者中開展的Ⅱ期臨床試驗療效及安全性結果更新(摘要編號:2592)
試驗設計
此研究是一項在標準治療失敗的、不可切除或轉移性MSI-H/dMMR實體瘤患者中進行的旨在評價斯魯利單抗療效、安全性及耐受性的單臂、開放標籤、多中心、II期臨床試驗。納入的患者每兩周靜脈輸注3 mg/kg斯魯利單抗,最多持續兩年,或直到疾病進展、出現不可接受的毒性或患者退出。該試驗的主要終點為獨立影像評估委員會(IRRC)依據RECIST v1.1標準評估的客觀緩解率(ORR)。次要終點包括由研究者評估的ORR,以及緩解持續時間(DOR)、無進展生存期(PFS)、總生存期(OS)和安全性。
結果
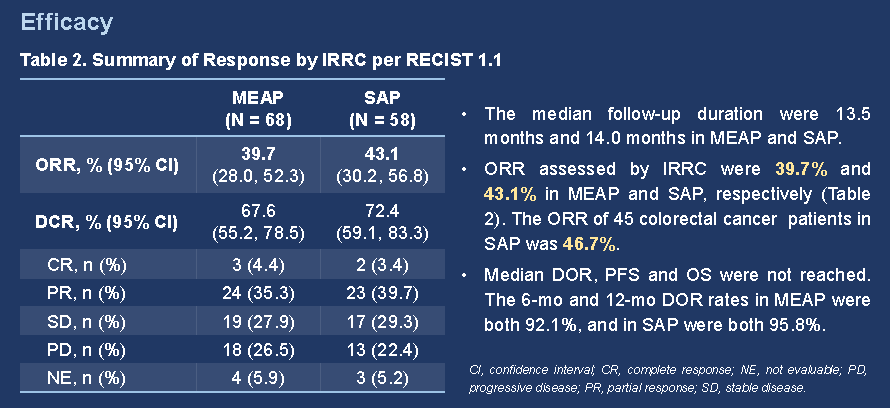
截至2021年7月10日,本試驗共入組108名患者並納入安全性分析集。其中68名經中心實驗室或研究中心確認MSI-H的患者被納入主要療效分析人群,58名經中心實驗室確認MSI-H,且無重大方案偏離的患者被納入敏感性分析人群。主要療效分析人群的中位隨訪時間為13.5個月,敏感性分析人群的中位隨訪時間為14.0個月。
主要療效分析人群及敏感性分析人群中,經IRRC依據RECIST v1.1評估的ORR分別為39.7%(95% CI 28.0–52.3;3例完全緩解)和43.1%(95% CI 30.2–56.8;2例完全緩解)。中位DOR、PFS及OS尚未達到。主要療效分析人群及敏感性分析人群的12個月生存率分別為74.5%和82.4%。
在安全性分析集中,57(52.8%)名患者經歷了三級及以上的治療期間出現的不良事件(TEAEs),其中最常見的為貧血(9.3%)。13(12.0%)名患者經歷了三級及以上的免疫相關不良事件(irAEs)。試驗中未觀察到新的安全信號。
結論
綜上所述,隨着隨訪時間的增加,斯魯利單抗仍展現出良好的抗腫瘤活性和安全性,為其作為一種有效的組織不確定類抗癌藥物提供了有力的支持。
