2022年6月6日,復宏漢霖(2696.HK)宣佈,公司首個創新型單抗H藥 漢斯狀®(斯魯利單抗)針對一線廣泛期小細胞肺癌(ES-SCLC)的國際多中心III期臨床研究(ASTRUM-005)在2022年美國臨床腫瘤學會(ASCO)年會由主要研究者吉林省腫瘤醫院程穎教授進行了口頭報告。這也是中國自主研發的抗PD-1單抗首次在一線肺癌領域以口頭報告形式在ASCO年會進行匯報,充分展現出中國醫藥企業在創新生物藥領先的研發能力和國際臨床運營實力。
程穎教授表示:「ASTRUM-005研究是首個由中國研究者牽頭開展的針對廣泛期小細胞肺癌的最大規模PD-1抑制劑的國際多中心臨床研究,全球114個研究中心的受試者參加了篩選,入組了超過31.5%高加索人種。研究結果顯示,斯魯利單抗聯合化療一線治療廣泛期小細胞肺癌的中位總生存為15.4個月,與對照組相比獲得顯著改善,獲得國際的認可,小細胞肺癌免疫治療實現新的跨越。」
復宏漢霖總裁朱俊表示:「H藥是復宏漢霖自主研製的創新單抗產品,我們聚焦未滿足的患者需求,在一線肺癌領域進行了全面佈局。目前公司針對SCLC的上市註冊申請已獲國家藥監局受理,H藥有望成為全球首個一線治療SCLC的抗PD-1單抗。希望這一適應症儘快獲批,早日填補臨床空白,為全球小細胞肺癌患者提供新的治療選擇。我們將不斷拓展更多臨床所需的治療方案,把中國生物藥的研究成果使全球患者獲益。」
ASTRUM-005在中國、土耳其、歐盟波蘭、格魯吉亞等多個國家共開設128個試驗中心,其中114個試驗中心有受試者參與了篩選,共入組585例受試者,其中約31.5%為高加索人。充分的國際臨床試驗數據也有望支持H藥在歐盟、美國等主流法規市場的申報,為全球臨床應用奠定基礎。此次公佈的試驗研究結果如下:
論文題目
創新型抗PD-1抗體斯魯利單抗聯合化療與單純化療在一線治療廣泛期小細胞肺癌中的比較:一項國際、隨機Ⅲ期臨床研究(摘要編號:8505)
試驗設計
本研究為一項在既往未接受過治療的ES-SCLC患者中開展的比較斯魯利單抗聯合化療(卡鉑-依託泊苷)及安慰劑聯合化療(卡鉑-依託泊苷)的有效性和安全性的隨機、雙盲、國際多中心、III期臨床研究。納入的患者按照2:1的比例隨機分為兩組,分別接受靜脈輸注斯魯利單抗或安慰劑聯合化療,每三周一次,直至疾病進展、死亡、毒性不耐受、受試者撤回知情同意,或出現方案規定的其他情況(以先發生者為準)。研究的主要終點為總生存期(OS)。次要終點包括無進展生存期(PFS)、客觀緩解率(ORR)、緩解持續時間(DOR)、安全性、藥代動力學特徵和免疫原性。
結果
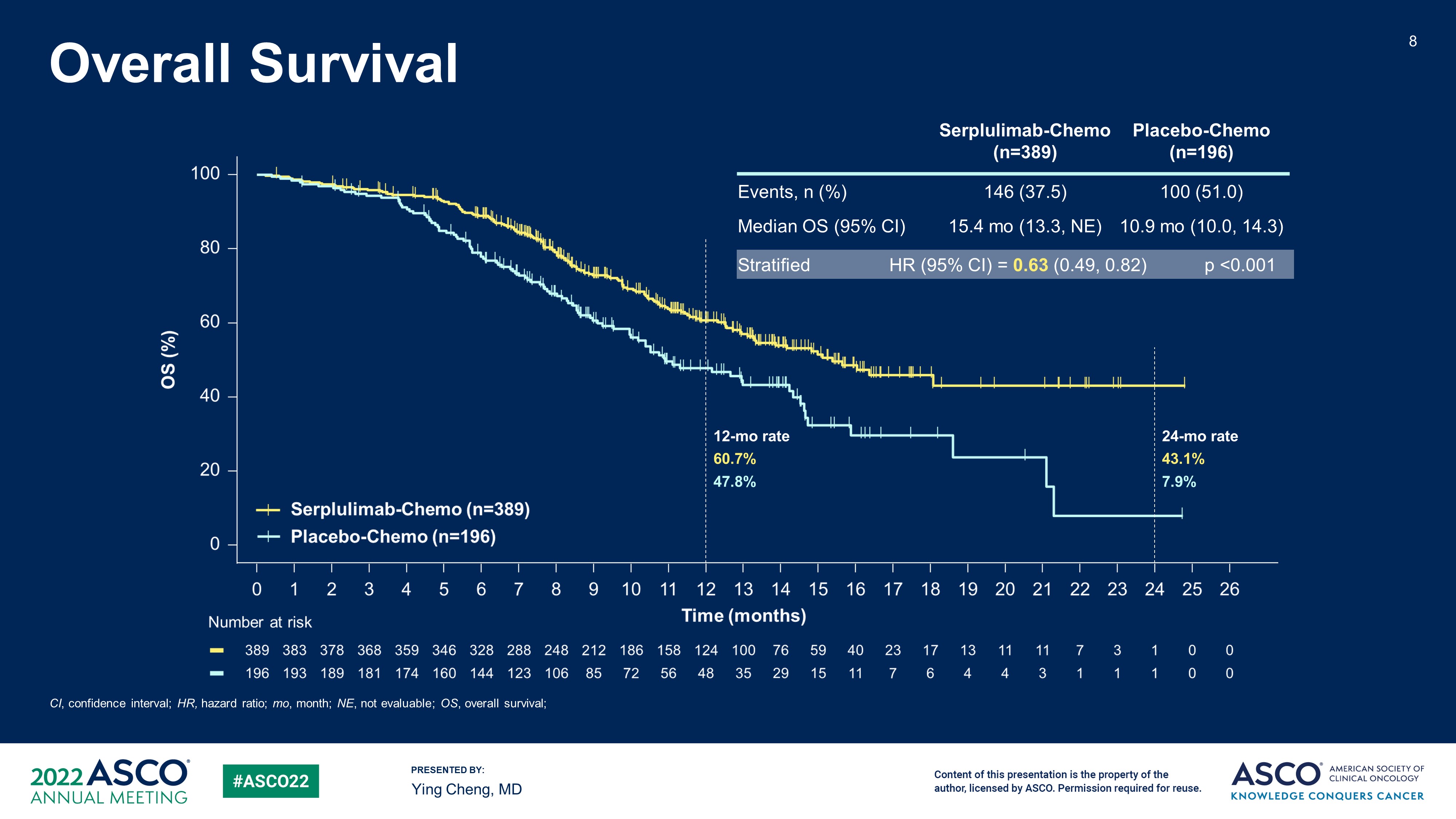
截至2021年10月22日,本研究共入組585名合格的患者(斯魯利單抗組,n=389;安慰劑組,n=196),中位隨訪時間為12.3個月。斯魯利單抗組和安慰劑組的中位OS分別為15.4個月(95% CI 13.3–NE)和10.9個月(95% CI 10.0–14.3),風險比(HR)為0.63(95% CI 0.49–0.82;p<0.001)。兩組的24個月總生存率分別為43.1%和7.9%。斯魯利單抗組及安慰劑組經獨立影像評估委員會(IRRC)依據RECIST v1.1評估的中位PFS分別為5.7和4.3個月(HR 0.48,95% CI 0.38–0.59)。IRRC依據RECIST v1.1評估的ORR(80.2% vs. 70.4%)及DOR(中位DOR,5.6 vs. 3.2個月)也能觀察到療效的提升。
兩個試驗組分別有129(33.2%)及54(27.6%)名患者發生三級及以上與斯魯利單抗或安慰劑相關的治療相關不良事件(TRAEs)。斯魯利單抗組的免疫相關不良事件(irAEs)發生率較安慰劑組高,且與已獲批的PD-1/PD-L1單抗相似。
結論
試驗結果表明,斯魯利單抗聯合卡鉑-依託泊苷能明顯改善一線ES-SCLC患者的OS,且其安全性與之前的研究結果一致。斯魯利單抗有望成為全球首個一線治療ES-SCLC的抗PD-1單抗產品,為此類患者提供一種新的治療選擇。
