間質表皮轉化因子 (c-Mesenchymal-epithelial transition factor, c-Met)是受體酪氨酸激酶的一種,較早就被發現在腫瘤細胞的活動中起到重要作用。這個蛋白對於腫瘤研究領域來說並不陌生,早在2008年,Nature Review Drug Discovery就發表過一篇關於c-Met抑製劑的詳細綜述[1]。這麼多年,涉及c-Met靶點的項目並不在少數,該靶點卻又未曾如EGFR或PD-1等明星靶點一般碩果累累,屢出新葯,其境遇頗像某些實力精湛卻又低調為人的老戲骨。近年來,由於基礎科研和臨床研究的諸多新的進展和發現,尤其最近諾華卡馬替尼的NDA申請被FDA受理並獲得優先審評、復宏漢霖抗c-Met單抗進入臨床試驗階段,讓c-Met靶向藥物的研發重新吸引了眾人目光。c-Met這個靶點也恰似奇峰陡起,再戰江湖。
c-Met過度激活:驅動癌變的關鍵信號
c-Met是表達在細胞表面的受體,其配體為肝細胞生長因子(hepatocyte growth factor,HGF)。HGF屬於可溶性細胞因子家族,也是纖溶酶原相關生長因子家族的成員。它由間充質細胞、成纖維細胞和平滑肌細胞合成,通過旁分泌機制激活HGF/c-Met信號,發揮其生物學功能。正常生理狀態下,HGF/c-Met可介導胚胎髮育、細胞增殖、受傷組織修復和神經肌肉的形成,並受抑癌基因p53的調控。如同Oct4等諸多胚胎幹細胞特徵密切相關的基因,一旦那層窗戶紙被捅破,它們往往會變成驅動生成腫瘤細胞的重要基因。
事實也確實如此。大量研究顯示,c-Met被過度激活,有可能會啟動正常細胞向腫瘤細胞轉化,並進一步帶動其侵襲、轉移、擴散等後續事件的發生。細胞癌變的一個典型標誌是出現上皮-間質轉化(epithelial- to-mesenchymal transition),而c-Met就被認為在其中起到了關鍵的驅動作用。此外,c-Met基因也是腫瘤幹細胞自我更新和克隆聚集重要的調控節點。
c-Met激活的細胞內下游信號通路主要方向包括:細胞增殖和分化、細胞生存、DNA修復等。當結合配體HGF後,c-Met通過形成二聚體和近膜區域若干位點的磷酸化實現活化,激活下游的一系列信號通路,啟動相關的細胞生理生化功能。參與和涉及c-Met信號通路的分子,許多都是大家耳熟能詳的腫瘤藥物研發領域明星靶點,諸如PI3K、GRB2、STAT3、GAB1、SHP2、RAS等,這些靶點的激活往往又會帶動其自身相關的更加複雜和龐大的調控網絡,可謂牽一髮而動全身。近年的不少臨床發現也顯示,c-Met基因突變正是在許多腫瘤藥物耐葯的關鍵所在。
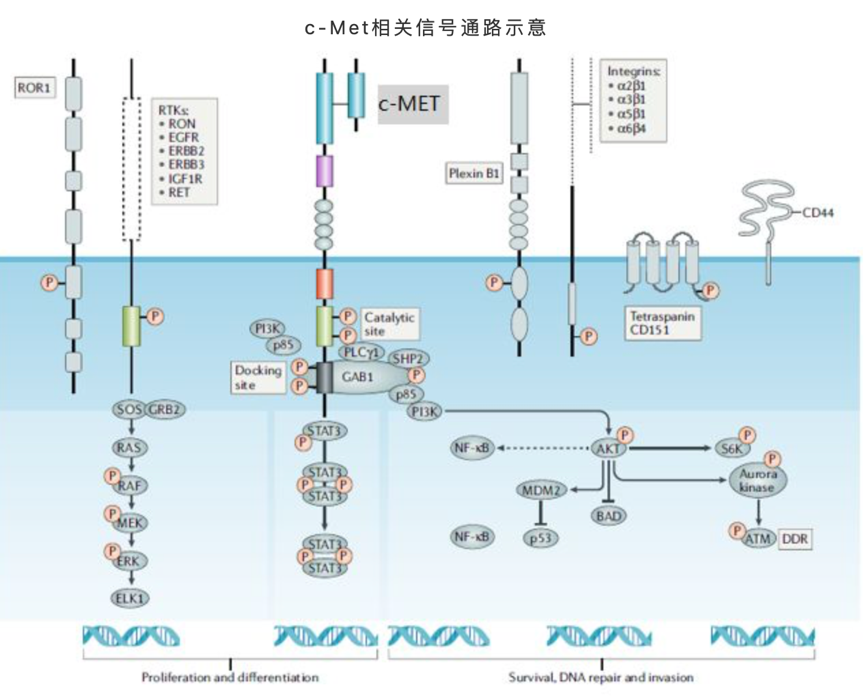
來源:Comoglio PM, et al [2]
c-Met基因異常:高頻癌種的中國特色
許多癌種類型中都存在c-Met基因的異常表達,諸如腦癌、乳腺癌、結直腸癌、胃癌、頭頸癌、肺癌、肝癌等。值得關注的是,c-Met基因異常表達的癌症類型中,好幾種都和中國人群密切相關,最為典型的就是胃癌和結直腸癌。
胃癌是全世界第四大常見的癌症,中國是全球胃癌最高發地區,根據Globocan流行病學統計數據,2015年全球新增胃癌患者103萬例,其中45萬例為中國患者,佔全球新增病人數的44%;且中國胃癌的初次診斷晚期比例較發達國家更高,因此帶來較高的死亡率。2015年中國胃癌死亡人數約36.5萬,位列國內惡性腫瘤死亡數第三位。大約10-20%的胃癌顯示c-Met基因拷貝數增加;中國胃癌病人c-Met基因突變陽性率約為25%。
結直腸癌也屬於中國高發疾病,發病率和死亡率均保持上升趨勢。根據Globocan流行病學統計數據,2015年全球新增結直腸癌180萬例,其中51萬例為中國患者,佔全球新增病人數的28%,且年輕人的發病率逐年增高;中國結直腸癌死亡病人數24萬例,佔全球結直腸癌死亡數的28%,每年遞增約4%,給患者、醫療保險以及社會造成沉重負擔。結直腸癌病人c-Met基因突變陽性率約為15.3%。
c-Met在不同癌種基因異常表達情況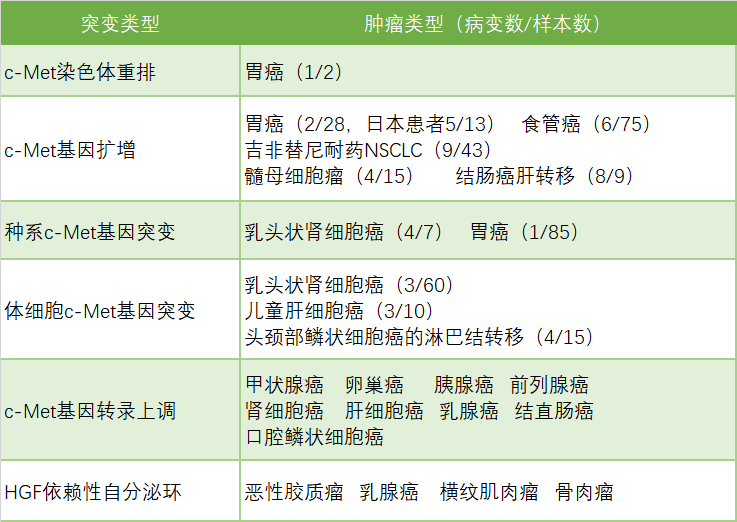
來源:Paolo M.Comoglio, et al [1]
外顯子14缺失:c-Met被阻斷的負向調控
如前所述,c-Met的不適當激活促進細胞增殖、細胞運動、侵襲性和血管生成,並與更具侵襲性的表型和較低的生存率相關。腫瘤細胞中,c-Met的調控機制可能包括:1)HGF配體激活表達;2)c-Met基因擴增引起過度表達;3)c-Met基因突變引起過度表達。這些變化往往會導致c-Met激酶信號通路的持續過度激活,甚至對配體的結合也變得過度敏感,進而引起細胞自發的持續增殖和癌症的進一步發展。
近年來最受關注的c-Met基因突變類型是外顯子14缺失突變。c-Met基因外顯子14位於蛋白近膜區域,與c-Met內吞和降解密切相關。由此可見,如果缺失了外顯子14片段,c-Met功能的內吞和降解會受到嚴重損失,帶來信號通路持續激活。
c-Met基因外顯子14缺失突變最早被發現於非小細胞肺癌(NSCLC)中,相關研究也比較充分。統計顯示,該突變在肺腺癌中的發生率約為3%,在肺腺鱗癌中的發生率約為5%,在化療耐葯的肺肉瘤癌中則高達32%。有臨床研究顯示,對於包含c-Met基因外顯子14缺失突變的肺腺癌患者,靶向抑制c-Met的策略已經展現出積極的臨床效果。越來越多的研究使得c-Met在NSCLC領域中正逐漸上升為與EGFR和ALK一樣重要的治療靶點。
小分子c-Met靶向藥物:從多激酶抑製劑到具有高選擇性的單一激酶抑製劑
靶向c-Met的在研新葯不在少數。根據醫藥魔方NextPharma數據庫,以c-Met為靶點,可以檢索到包括大分子和小分子在研藥物共計78項。不過目前已經上市的c-Met靶向藥物並不多。FDA目前只批准了兩款對包括c-Met在內的多種激酶都具有抑制效果的小分子藥物,大分子則還沒有c-Met靶向藥物獲批上市。
後續還有一些在研的特異性靶向c-Met靶點的小分子TKI,包括諾華的卡馬替尼(capmatinib,INC280)。今年2月,FDA受理了卡馬替尼的新葯上市申請(NDA),並授予優先審評資格。由於FDA向一項NDA授出優先審評資格的條件是要求其在臨床試驗中展示出了優於當前現有療法的數據,這也說明有足夠證據顯示特異性抑制c-Met信號通路相比標準療法能夠顯著改善這類患者的治療效果,而卡馬替尼背後的科學機制也受到主流市場監管機構的重視。如果卡馬替尼獲批,也將為全球其他c-Met抑製劑的開發增強信心。
中國也有若干在研的多靶點或單靶點c-Met抑製劑,不過大分子類的c-Met特異性抑製劑項目目前仍是鳳毛麟角。
HLX55單抗:從阻斷到降解,雙機制抑制c-Met通路
作為細胞膜表面的靶點,c-Met為抗體類藥物開發提供了機會。靶向c-Met的單抗藥物選擇性強,安全性優勢也比較明顯。此外,大分子藥物半衰期較長,用藥頻率較低,患者用藥依從性較好。
目前全球尚無靶向c-Met的大分子藥物獲批上市,在研大分子c-Met抑製劑多數都是單抗藥物,也有個別是抗體偶聯藥物和雙抗。目前國內公司獲批進入臨床的大分子c-Met抑製劑包括復宏漢霖的HLX55和恆瑞的SHR-A1403。復宏漢霖的HLX55在臨床前體外和動物模型中均顯示出抗腫瘤作用和良好的安全性,為後續開展人體臨床試驗提供了科學基礎。HLX55已於2019年9月和10月相繼獲得台灣TFDA和中國大陸NMPA的臨床試驗批准。近日,HLX55針對晚期實體瘤的臨床I期研究已經在中國台灣完成首例患者給葯。
HLX55是一種人源化IgG2。有意思的是,作為單抗類藥物,HLX55可以高效特異阻斷c-Met與配體的結合之外,還有一項獨特的優勢:可以同時誘導c-Met內吞和降解。通過這樣的雙重作用機制,增強了對c-Met信號通路的抑制作用,從而有望展現出更強的抗腫瘤作用效果。
正如此前提到,外顯子14在正常生理狀態下,對於誘導c-Met降解並下調c-Met通路信號至關重要,外顯子14的缺失正是c-Met通路過度活化的重要原因。HLX55的臨床前數據顯示,即使是在c-Met基因外顯子14缺失的肺癌細胞系中,HLX55依然可以成功誘導目標蛋白降解,對於c-Met基因外顯子14缺失突變引起的耐葯群體,HLX55這個特徵在臨床上可能有着更為重要的意義。
綜合來看,HLX55作為一款靶向c-Met的創新單抗藥物,未來有望為c-Met異常活化相關的腫瘤患者人群帶來更為精準高效的治療選擇,對於復宏漢霖則有着深入積累對c-Met相關信號通路的了解與數據、進一步豐富抗腫瘤產品管線布局、增加管線覆蓋瘤種的戰略意義。c-Met突變的主要癌種,包括肺癌、結直腸癌和胃癌,均是其高度關注的適應症。另外也值得注意的是,HLX55在動物模型實驗中,即使微小劑量(0.1mg/kg)也能對人膠質母細胞瘤產生較好的抑制作用(見下圖)。HLX55的推進,勢必能夠進一步加強復宏漢霖在這些領域的競爭優勢與市場地位。
不同劑量HLX55在人膠質母細胞瘤異種移植模型中對腫瘤的抑制作用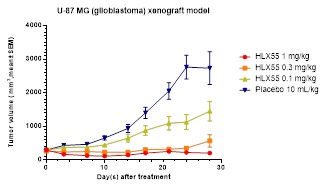
HLX55聯合用藥與相關雙抗未來可期
除了單獨用藥,c-Met抑製劑與其他抗腫瘤藥物聯用的潛力也在受到越來越多的關注,研究較多的是EGFR抑製劑。
c-Met突變在肺癌中被研究得較為充分,是引起EGFR TKI耐葯的重要原因。包括當紅明星,三代EGFR TKI奧希替尼耐葯,除了熟知的C797S突變外,c-Met基因突變擴增同樣是耐葯的主要原因。國際國內的多項臨床研究曾顯示,EGFR抑製劑和c-Met抑製劑聯用,臨床上顯示出很好的治療效果。吳一龍教授就曾在2018年ESMO報道,c-Met抑製劑聯合EGFR抑製劑吉非替尼,對既往EGFR-TKI耐葯的c-Met突變EGFR陽性非小細胞肺癌患者能夠取得較好的治療效果。這些結果也為未來HLX55適用場景的進一步拓展提供了想像空間。
此外,c-Met通路異常作為一些腫瘤發生和出現耐葯的驅動因素,其抑製劑與靶向PD-1等腫瘤免疫治療相關靶點的藥物以及抗血管生成相關靶點的藥物可能存在較好的互補協同作用。若未來有聯合用藥的探索,則可以同時針對腫瘤發生和發展的「內因」以及腫瘤微環境「外因」雙管齊下,是一個值得關注的方向。
不僅如此,HLX55潛在的聯合用藥可能,對於復宏漢霖這樣Pipeline和腫瘤治療的靶點布局都已經十分完備的創新型葯企,毫無疑問意味着更多的協同機會,這也與復宏漢霖一直着力推進的「Global+Combo」聯合治療戰略相吻合。復宏漢霖已經擁有HLX07 (EGFR),完全可以探索EGFR+c-Met的自有單抗組合聯用。此外,包括具有抗血管生成作用的HLX04(VEGF),以及腫瘤免疫檢查點抑製劑HLX10 (PD-1) 、HLX20(PD-L1) 等在研品種,也有機會嘗試與HLX55的聯合用藥。考慮到c-Met抑制在胃癌治療上的潛力,HLX55與HLX22(新型抗HER2單抗)的聯合也許能夠為胃癌的治療帶來嶄新的思路。由於自有產品線豐富,開展聯合用藥研究所需的溝通成本、實際可執行性等方面都具有較大的優勢。
除了聯合用藥,HLX55作為抗c-Met單抗,其開發過程無疑能夠為復宏漢霖積累豐富的c-Met抗體與受體相互作用、藥效結構等方面的數據與經驗,在此基礎上再依託復宏漢霖在腫瘤免疫和抗血管生成相關靶點的抗體研發經驗,以及已經建立起的完善的雙特異性抗體研發平台,有理由期待c-Met/PD-1、c-Met/EGFR等靶點組合的雙特異性抗體是一個值得進一步期待與評估的方向,有望顯著提升復宏漢霖現有Pipeline的價值和市場機會。
國內外也有若干c-Met/PD-1、c-Met/EGFR雙抗在早期研究中取得了積極數據,為這一方向的可行性積累了更多證據[3-6]。例如,羅氏的一項早期研究結果顯示,其研發的c-Met/EGFR雙抗(MetHer1)在HGF高表達的NSCLC異種移植小鼠模型中展示出了強效的抗腫瘤效果,且對人前列腺癌細胞系遷移及侵襲的抑制效果強於抗c-Met單抗與抗EGFR單抗聯合給葯的抑制效果[4]。
另外一款強生在研的c-Met/EGFR雙抗(JNJ-61186372)也對c-Met或/和EGFR驅動的NSCLC腫瘤模型展現出了較好的抑制效果,且在食蟹猴體內研究中未觀察到重大毒性[6]。國內的一項研究顯示c-Met/PD-1雙抗在體外實驗中能夠有效抑制c-Met和PD-L1均高表達的胃癌細胞和肺癌細胞的生長、遷移和抗凋亡作用[3]。
參考文獻:
[1] Paolo M. Comoglio, Silvia Giordano andLivio Trusolino. Drug development of MET inhibitors: targeting oncogeneaddiction and expedience. doi: 10.1038/nrd2530.
[2] Comoglio PM, Trusolino L, Boccaccio C.Known and novel roles of the MET oncogene in cancer: a coherent approach totargeted therapy. doi: 10.1038/s41568-018-0002-y.
[3] Zu-Jun Sun, Yi Wu, Wei-Hua Hou,Yu-Xiong Wang, Qing-Yun Yuan, Hui-Jie Wang and Min Yu. A novel bispecific c-MET/PD-1antibody with therapeutic potential in solid cancer. doi:10.18632/oncotarget.16173.
[4]Castoldi R, Ecker V, Wiehle L, Majety M,Busl-Schuller R, Asmussen M, Nopora A, Jucknischke U, Osl F, Kobold S, ScheuerW, Venturi M, Klein C, Niederfellner G, Sustmann C. A novel bispecific EGFR/Metantibody blocks tumor-promoting phenotypic effects induced by resistance toEGFR inhibition and has potent antitumor activity. Oncogene. 2013; 32:5593-601.
[5]Bok-Soon Lee, Haeng-Jun Kim, Jae-WoongHwang, Kwang Ho Cheong, Kyung-Ah Kim, Hyun-Young Cha, Ji Min Lee, Chul-Ho Kim.The dual inhibition of Met and EGFR by ME22S, a novel Met/EGFR bispecificmonoclonal antibody, suppresses the proliferation and invasion of laryngealcancer. Ann Surg Oncol. 2016, 23:2046-53.
[6] Moores SL, Chiu ML, Bushey BS,Chevalier K, Luistro L, Dorn K, Brezski RJ, Haytko P, Kelly T, Wu SJ, MartinPL, Neijssen J, Parren PW, et al. A Novel Bispecific Antibody Targeting EGFRand cMet Is Effective against EGFR Inhibitor-Resistant Lung Tumors. Cancer Res.2016;76:3942–53.
