【首部中國生物類似藥專家共識出爐,臨床應用將有章可循】。
生物葯因其明確的療效優勢而暢銷全球,然而生物葯動輒高昂的價格,又讓患者不堪重負。生物類似葯的上市打破了生物葯市場壟斷的格局,通過有效的競爭明顯的降低了患者支付負擔。但中國醫療專業人士、患者及公眾對生物類似葯的概念仍然很陌生。
今日上午,由中國臨床腫瘤學會(CSCO)中國抗淋巴瘤聯盟主辦的中國生物類似藥專家共識發佈會成功舉行,北京大學腫瘤醫院朱軍教授、上海交通大學附屬瑞金醫院沈志祥教授、哈爾濱血液病腫瘤研究所所長馬軍教授與中國醫學科學院腫瘤醫院石遠凱教授擔任本次會議主席。會上正式發佈了首部《中國生物類似藥專家共識》(以下簡稱《共識》),以規範我國生物類似葯的臨床用藥,幫助正確認識生物類似葯這一新興的概念。
《共識》主要包含五方面的內容:生物類似葯概述、生物類似葯的有效性、生物類似葯的安全性、生物類似葯的轉換、生物類似葯的可及性。會議期間北京大學腫瘤醫院宋玉琴教授對《共識》進行了深度解讀。《共識》中有哪些重點內容?讓我們一睹為快!
《共識》促成三大核心
指導生物類似葯的臨床使用
▍ 生物類似葯與參照葯高度相似,二者差異性被嚴格控制
生物類似葯是指在質量、安全性和有效性方面與已獲准註冊的參照葯具有相似性的治療用生物製品[1]。具有四個重要特徵:與參照葯高度相似,與參照葯的臨床意義相同,生物類似葯的差異性被嚴格限制,生物類似葯的質量、安全性和有效性有嚴格標準[2,3]。由於生物葯的自然變異性和複雜的生產工藝,導致生物類似葯與參照葯只能做到高度相似[1,2],兩者的允許差異範圍與參照葯批次間允許的差異範圍相同(圖1)。
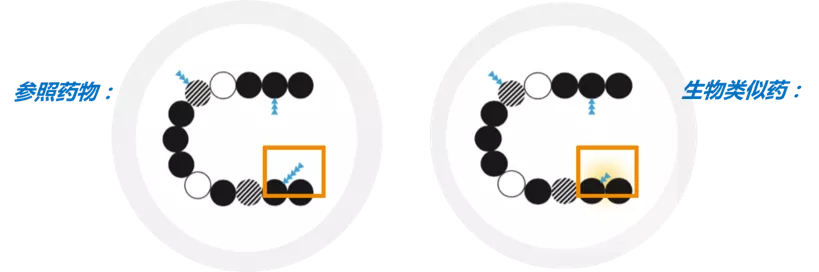
圖1. 生物類似葯和參照葯之間的差異性(黃色陰影)
允許糖基化(藍色小三角形表示)方面的差異,但蛋白質氨基酸序列(圓圈)一致
▍生物類似葯火熱朝天,漢利康成為中國首個獲批的生物類似葯
隨着越來越多的原研生物藥專利到期,全球生物類似葯呈現出熱火朝天的發展景象。根據Clarivate Analytics Cortellis數據庫,截至2019年5月29日[4],全球處於活躍狀態的生物類似葯共718個,其中,單克隆抗體占整個生物類似葯的52.4%。生物類似葯的開發主要集中在腫瘤、免疫以及血液疾病,這三大領域研發數量佔56%。截至2020年3月,歐盟已批准65個生物類似葯[5],美國食品藥品監督管理局(FDA)批准26個生物類似葯[6]。
中國有27個生物類似葯處於研髮狀態,約有一半處於臨床前研究階段,有10個已獲得臨床批件。截至2019年12月,我國共有4個生物類似葯獲批上市,其中復星醫藥生物葯平台復宏漢霖研發生產的利妥昔單抗注射液漢利康(HLX01)於2019年2月22日獲批上市,是我國首個獲批上市的生物類似葯[7]。
由復星醫藥生物葯平台復宏漢霖研發生產的阿達木單抗生物類似葯HLX03的上市申請正在受理中,2019年的歐洲抗風濕聯盟(EULAR)會議公布了阿達木單抗生物類似葯HLX03與參照葯阿達木單抗的I期試驗結果。這項隨機、雙盲、單劑量、平行比較研究證實了HLX03和阿達木單抗在PK方面具有生物等效性。HLX03與阿達木單抗的Cmax、AUClast的幾何均數比值的雙側90%CI在80%-125%範圍內。組間AUC0-inf幾何均數比值的雙側90%CI也在等效範圍內,進一步證實了兩種藥物的PK生物等效性。另外,該項研究證實二者在安全性和免疫原性也具有相似性。
▍生物類似葯與參照葯療效等同、安全性相似,可替代使用和轉換
目前資料表明生物類似葯在臨床試驗或臨床使用中與參照葯療效相似。例如,漢利康的3期隨機雙盲對照「頭對頭」臨床試驗中,漢利康與參照葯的客觀緩解率(ORR)組間差異為1.4%,符合國家藥品審評中心(CDE)規定的±12%等效性界值區間,表明漢利康與參照葯具有臨床等效性[8]。兩項分別納入了1534例患者[9]與3163例患者[10]的Meta分析證實,已上市利妥昔單抗生物類似葯與參照葯臨床等效。
過去十年,在歐盟的安全監控系統中尚未發現生物類似葯與參照葯之間存在不良反應性質、嚴重程度或發生頻率的差別。相關上市前和上市後研究顯示,生物類似葯的安全性與其參照葯類似[11],且生物類似葯在外推適應症中使用的安全性與參照葯類似 [12,13]。因此,生物類似葯在安全性方面,包括不良事件的發生率、免疫原性及外推適應症等,與參照葯相似,可以被安全地用於臨床實踐。
而藥物轉換是指由處方醫生決定將一種藥物轉換為另一種治療用途相同的藥物。目前臨床醫師對生物類似葯的轉換主要有生物類似葯和參照葯之間的轉換、生物類似葯之間的轉換兩方面,其中生物類似葯與參照葯之間的轉換較多見。相關研究表明從參照葯轉換到對應的生物類似葯不會產生任何新的安全性事件[14]。基於國內國家藥品監督管理局(NMPA)對臨床轉換暫無具體規定,參考國外其他國家的規定,建議主要由臨床醫生根據臨床實際決定,但需要與患者做好知情協商。
最後,宋玉琴教授強調,生物類似葯的出現可以說大大提高了患者用藥的可及性。生物類似葯以低於其參照藥物的價格推向市場,在增加市場競爭的同時,可以降低複雜醫療條件下的總體護理成本[15],生物類似葯的發展有助於為患者和社會帶來真正的價值。
鑒於生物類似葯所表現出的與參照葯的高度相似性,該《共識》最終達成了三個核心共識(圖2)以指導生物類似葯的臨床使用。

圖2. 《共識》達成的三個核心共識
那麼,《共識》對未來臨床工作有哪些積極意義?會上多位專家對該議題進行了熱烈的討論。
南京醫科大學第一附屬醫院徐衛教授:大規模臨床試驗及真實世界數據顯示漢利康與其參照葯療效等同,安全性相似,可以安全的用於臨床實踐。《共識》的發佈有助於推動中國生物類似葯的發展、提高患者生活質量、並降低醫保費用。
復旦大學附屬腫瘤醫院李小秋教授:祝賀《共識》的成功發佈,希望復星醫藥更多造福國內外淋巴瘤及有需要的患者。
江西省腫瘤醫院雙躍榮教授:《共識》的發佈對臨床醫生非常有指導意義,宋教授的精彩解讀也解決了很多臨床醫生關於生物類似葯的適應症外推和轉換的疑惑。有了《共識》作為指導,醫生可以更放心地在臨床實踐中使用生物類似葯,並根據患者情況進行藥物轉換。生物類似葯的發展使患者有更大的可及性和獲益。
河北醫科大學第四醫院劉麗宏教授:通過本次發佈會學習到生物類似葯與參照葯療效相同、免疫原性相同、安全性相似,並可以外推到其他適應症。藥物可相互轉換使得臨床醫生可以根據患者情況決定使用參照葯還是生物類似葯。生物類似葯的上市有助於市場發展,降低醫保費用,使更多患者獲得使用藥物的權利。
山西省腫瘤醫院蘇麗萍教授:漢利康是中國首個上市的生物類似葯,其與參照藥頭對頭的臨床研究提供了最大的證據級別,它與原研葯具有一樣的品質,相互轉換沒有任何影響。漢利康是領域內里程碑似的發展,臨床醫生有責任推動漢利康的臨床應用,推動國家在生物類似葯領域的發展。
中國醫科大學附屬盛京醫院劉卓剛教授:《共識》的發佈讓臨床醫生在使用生物類似葯時有更好的依據,生物類似葯葯優價低,能讓患者獲得更大獲益。漢利康的出口亦證明了我國在藥物研發上的進步。
吉林大學白求恩第一醫院白鷗教授:臨床研究和真實應用證明漢利康療效肯定、安全性可靠。其在適應症上可外推,也可與參照葯和其他生物類似葯轉化。漢利康為我國生產,成本低,具有價格優勢,患者獲益更高、可及性更好,也使得臨床上有了更多的選擇,臨床醫生有責任推動生物類似葯的推廣。臨床上需要這樣的《共識》,使得醫生有據可循,且能更有信心、有把握地使用生物類似葯。
宋玉琴教授:漢利康的上市推動了《共識》的制定和發佈,《共識》的發佈會在未來的臨床工作上給予指導,對患者、我國醫保系統降低成本非常有意義。
熱度持續發酵,《共識》發佈會後復星淋巴血液最新進展高峰會又將會場氣氛帶入新的高潮。
B細胞淋巴瘤治療,
利妥昔單抗的地位不可取代
首先中山大學附屬腫瘤醫院淋巴瘤治療研究中心黃慧強教授帶來《2020年B細胞淋巴瘤領域MVP(the Most Valuable Progress)盤點》。
淋巴瘤是一種起源於淋巴造血系統的惡性腫瘤,流行病學顯示其發病率約為6.9/10萬,5年患病人數約157.6萬。67%的淋巴瘤為B細胞淋巴瘤。當前,B細胞淋巴瘤的臨床治療仍面臨年老體弱者無耐受藥物、部分難治/複發患者無有效治療方案、早期複發患者預後差及疾病異質性強、臨床缺少有效的預後模型等痛點。抗體靶向類藥物、小分子靶向藥物及細胞免疫治療等新葯的出現為解決B細胞淋巴癌臨床痛點帶來希望。
目前B細胞淋巴瘤的治療仍以CD20單抗為主,其中利妥昔單抗在聯合化療或者聯合新葯中的地位不可取代,利妥昔單抗與新葯的聯合為部分複發/難治患者帶來希望。以伊布替尼為主的小分子靶向抑製劑為慢性淋巴細胞白血病(CLL)患者帶來較深的緩解,也預示着利妥昔單抗聯合來那度胺治療的無化療時代的到來。細胞免疫療法是難治性淋巴瘤患者的希望,但仍需更多研究規避此療法帶來的毒副反應。
劍指血小板減少症,
新一代TPO-RA阿伐曲泊帕國內獲批
山東大學齊魯醫院侯明教授帶來《新型TPO-RA在血液領域應用研究進展》。
血液系統血小板減少症(TCP)發生率較高,新型血小板生成素受體激動劑(TPO-RA)在血液病領域的應用前景廣闊。2020年4月15日,NMPA批准阿伐曲泊帕(蘇可欣)用於擇期行診斷性操作或者手術的慢性肝病相關血小板減少症的治療,是目前獲批的最新一代TPO-RA。阿伐曲泊帕可強效快速升血小板,口服方便,不受飲食限制,為血小板減少症患者帶來獲益。新型TPO-RAs在免疫性血小板減少症(ITP)領域的應用已得到國內外指南的一致推薦,可作為二線治療的優選。
靶向難治侵襲性淋巴瘤患者,
中國首個自體CAR-T細胞治療產品有望落地
北京大學腫瘤醫院應志濤教授帶來《CAR T細胞治療在淋巴瘤中的應用價值及存在問題》。
近年來,嵌合抗原受體T細胞免疫療法(CAR-T)在急性淋巴細胞白血病和非霍奇金淋巴瘤的治療上有着顯著的療效,被認為是最有前景的腫瘤治療方式之一。
ZUMA-1研究是一項探究Axi-Cel(CAR-T細胞治療產品)治療耐葯、侵襲性B細胞非霍奇金淋巴瘤(NHL)的療效與安全性的單臂、多中心I~II期關鍵臨床研究。ZUMA-1研究結果顯示,患者ORR為83%,完全緩解率為58%。ZUMA-1長期隨訪(中位隨訪27.1個月)結果顯示,93%的在12個月時持續緩解的患者,在24個月時仍處於緩解中,藥物療效持久性佳[16]。
2020年2月,Axi-Cel落地國內的CAR-T細胞治療產品FKC876的藥品上市註冊審評獲受理,將用於成人複發難治性大B細胞淋巴瘤治療。中國境內尚無與該產品具有相同靶點的同類藥物獲批上市。FKC876有望為中國難治侵襲性淋巴瘤患者帶來新生的希望。
附:CSCO生物類似藥專家共識專家組成員:
參考文獻
[1] 《生物類似葯研發與評價技術指導原則(試行)》.國家食品藥品監督管理總局(2015)
[2] Biosimilars in the EU(Information guide for healthcare professionals), European Medicines Agency and the European Commission(2019).
[3] 2015《中國藥典》三部
[4] Clarivate Analytics Cortellis (數據截至2019.05.29)
[5] Biosimilars in the EU © European Medicines Agency;www.ema.europa.eu
[6]https://www.fda.gov/drugs/biosimilars/biosimilar-product-information
[7] http://www.nmpa.gov.cn
[8] Yuankai Shi, et al. First China Approved Rituximab Biosimilar HLX01: Pharmacokinetics, Safety and Efficacy Comparison to Reference Rituximab in the Phase 3 Diffuse Large B-Cell Lymphoma Study, 2019, ASH, oral abstract 2878.
[9] Yang J, Yu S, Yang Z, et al. Efficacy and Safety of Anti-cancer Biosimilars Compared to Reference Biologics in Oncology: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. BioDrugs. 2019;33(4):357-371.
[10] Lee S, Lee H, Kim E, Comparative Efficacy and Safety of Biosimilar Rituximab and Originator Rituximab in Rheumatoid Arthritis and Non-Hodgkin\'s Lymphoma: A Systematic Review and Meta-analysis. BioDrugs 2019;33(5): 469-483.
[11] Braun J, Kay J. The safety of emerging biosimilar drugs for the treatment of rheumatoid arthritis. Expert Opin Drug Saf. 2017;16(3):289–302.
[12] Park SH, Kim YH, Lee JH, et al. Post-marketing study of biosimilar infliximab (CT-P13) to evaluate its safety and efficacy in Korea. Expert Rev Gastroenterol Hepatol. 2015;9(suppl 1):35-44.
[13] Fiorino G, Manetti N, Variola A, et al. Prospective observational study on inflammatory bowel disease patients treated with infliximab biosimilars: preliminary results of the PROSIT-BIO cohort of the IG-IBD. J Crohns Colitis 2016; 10(suppl 1): S376-S377.
[14] Griffiths CEM, et al. The EGALITY study: a confirmatory, randomized, double-blind study comparing the efficacy, safety and immunogenicity of GP2015, a proposed etanercept biosimilar, vs. the originator product in patients with moderate-to-severe chronic plaque-type psoriasis. Br J Dermatol. 2017;176(4): 928-938.
[15] Aladul MI, Fitzpatrick RW, Chapman SR. The effect of new biosimilars in rheumatology and gastroenterology specialities on UK healthcare budgets: Results of a budget impact analysis. Res Social Adm Pharm. 2019;15(3):310-317.
[16] Frederick L Locke, et al. Long-term safety and activity of axicabtagene ciloleucel in refractory large B-cell lymphoma (ZUMA-1): a single-arm, multicentre, phase 1-2 trial. Lancet Oncol. 2019; 20(1): 31-42.
