9月20日,復宏漢霖注射用曲妥珠單抗HLX02 3期臨床試驗階段性數據由徐兵河教授以口頭報道的形式於第22屆全國臨床腫瘤學大會暨2019年CSCO學術年會現場發佈,現場展示信息如下:

以下為本次數據發佈的詳細信息:
研究背景與目的
乳腺癌是女性最常見的癌症,全球範圍內均具有較高的發病率和死亡率。曲妥珠單抗已被大量研究證明可提高HER2陽性乳腺癌患者的總體生存率,並被國內外權威指南推薦應用於乳腺癌的一線治療。然而由於生物製品普遍高昂的葯價,優質藥品供貨時常短缺,全球仍有許多乳腺癌病患無法得到曲妥珠單抗的使用,錯失優質治療機會。
HLX02是復宏漢霖自主研發的注射用曲妥珠單抗,該生物類似葯的開發旨在滿足當前全球乳腺癌患者對高質量藥品的需求。其開發遵從國家藥品監督管理局(NMPA)和歐洲藥品管理局(EMA)生物類似葯指導原則,先後於2018年CSCO年會和2018年ESMO-ASIA年會上發佈了其1期臨床試驗(NCT02581748)的結果,證實了HLX02與不同來源的原研曲妥珠單抗(國內市售和歐洲市售)達到葯代動力學生物等效,安全性相似。
今天發佈的HLX02在複發或未經治療的HER2陽性轉移性乳腺癌患者中開展的隨機、雙盲、平行對照的3期臨床試驗(臨床試驗號:NCT03084237 和歐洲臨床試驗號: 2016-000206-10)的階段性數據,旨在比較HLX02與原研曲妥珠單抗(歐洲市售)在該試驗人群中的有效性和安全性。
研究方案
試驗共入組649例患者,患者需滿足:≥18歲的複發性或轉移性乳腺癌患者、病理檢測HER2陽性(FISH≥2.0或IHC得分3+)、未進行過全身性化療或靶向藥物治療、體力狀況較好(ECOG評分0~1)等條件。將患者按照1:1的比例隨機分為兩組,分別給予HLX02聯合多西他賽治療或歐洲市售曲妥珠單抗聯合多西他賽治療。兩組患者均採用每3周給葯一次,最多至12個月的方案給葯。主要療效終點為24周的最佳客觀緩解率(ORR24)。
研究結果
本屆CSCO大會上,我們公布了該試驗的階段性分析數據,截至2018年11月27日,所有隨機患者主要終點24周的最佳客觀緩解率評估已經完成。該數據已提交至NMPA和EMA並獲得上市申請受理,隨後HLX02被NMPA納入優先審評程序。
有效性結果
除此之外,在亞組分析人群中(中國 vs 非中國),HLX02組與原研曲妥珠單抗組ORR24周均無統計學差異(P>0.05),HLX02組與原研曲妥珠單抗組在不同人群中的療效相似。進一步驗證了HLX02和原研曲妥珠單抗療效的相似性。
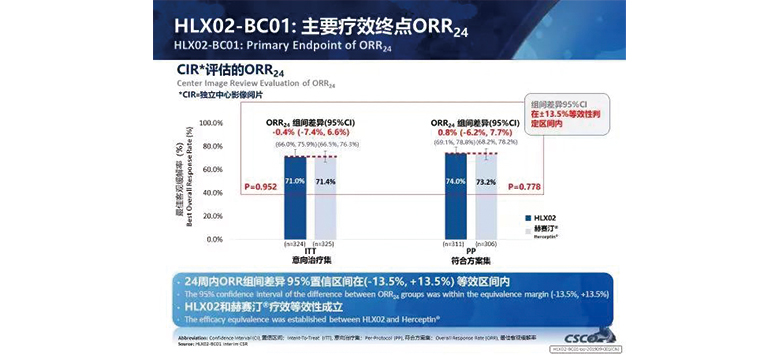
次要療效臨床終點如臨床獲益率(CBR),疾病控制率(DCR),緩解持續時間(DoR),無進展生存期率(PFS),總生存率(OS)等,兩個治療組間無明顯統計學差異(P>0.05)。
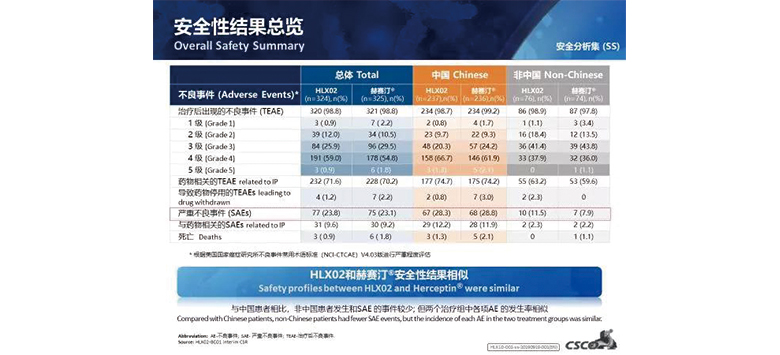
安全性結果
在安全性方面,兩組均未發生超出預期的不良事件。在不良事件中與藥物相關的心臟疾病的發生率和嚴重程度上,HLX02組和原研曲妥珠單抗組相似。
結論
上述結果已經充分證明了HER2陽性複發或轉移性乳腺癌患者中,HLX02和原研曲妥珠單抗具有相似的療效和安全性。
該試驗最後一例病人於今年8月完成隨訪收案,隨後鎖庫。現試驗處於生存期隨訪階段(隨訪至3年),一旦分析結束,我們會及時公布關於該試驗的更多安全性和有效性結果。
