9月20日,復宏漢霖了參與第22屆全國臨床腫瘤學大會暨2019年CSCO學術年會,並由鄭偉宏醫師口頭報道了復宏漢霖創新型重組抗PD-1人源化單克隆抗體注射液——HLX10在複發或轉移性晚期實體瘤中的1期臨床試驗(NCT03468751)階段性數據,具體展示信息如下:

以下為本次數據發佈的詳細信息:
研究背景與目的
近年來,程序性細胞死亡蛋白-1(PD-1)及其配體(PD-L1)因獨特的作用機制和相對低的副作用等特點,引起了全球醫療研究人員的極大關注,並在眾多腫瘤治療領域取得了令人矚目的成果。HLX10作為復宏漢霖自主研發的創新型單抗,體外試驗被證實能夠增強T細胞的功能,並在腫瘤移植模型中表現出抗腫瘤活性。
今天,我們公布了HLX10在複發或轉移性晚期實體瘤中的1期臨床試驗的初步試驗數據,該試驗旨在探索HLX10在晚期或轉移性實體瘤患者中的安全性、耐受性、劑量限制性毒性(DLT)、最大耐受劑量(MTD)、葯代動力學(PK)和初步療效。
另外,研究證明,與抗血管生成藥物聯合化療相比,免疫療法聯合抗血管生成療法的治療方案具有可接受的毒性。基於上述背景,我們將進一步在晚期實體瘤中探索免疫治療與抗血管生成治療的聯合療法,評價HLX10聯合HLX04(貝伐珠單抗生物類似葯)治療方案的療效和安全性。
研究方案
HLX10的1期臨床試驗為多中心劑量探索試驗,採用貝葉斯最優區間設計探索HLX10在標準治療耐葯的晚期或轉移性實體瘤患者中的安全性、耐受性、DLT、MTD、PK和初步療效。入組後,患者每兩周接受靜脈輸注劑量分別為0.3、1、3、10 mg/kg 的HLX10直至疾病進展,退出試驗,死亡或治療滿12個月。首次給葯28天後觀測DLT。使用1.1版實體瘤的療效評價標準(RECIST)和免疫RECIST(iRECIST)評價臨床療效,前24周每8周評價一次,之後每12周評價一次。在試驗期間同步評估安全性、免疫原性、PK和初步療效。
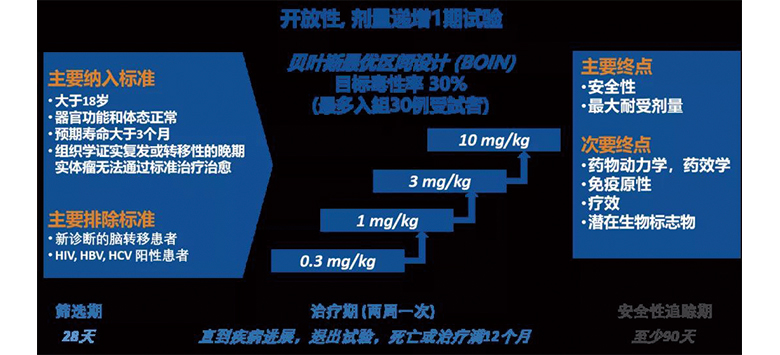
研究結果
HLX10在2017年底被台灣食品藥品管理局和美國食品藥品管理局批准進行臨床試驗。患者招募於2018年初開展,截至2019年7月31日,共17例患者接受了不同劑量的HLX10治療。
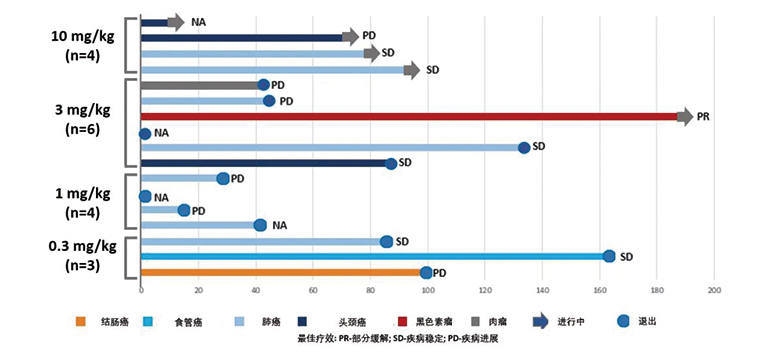
有效性結果
在13例接受療效評估的患者中,6例患者(2例來自0.3 mg/kg劑量組,2例來自3 mg/kg劑量組,2例來自10 mg/kg劑量組)觀測到疾病穩定,1例觀測到部分緩解(來自3 mg/kg劑量組)。
安全性結果
各劑量組均未發現輸注反應。大於2級的不良事件包括急性胰腺炎、澱粉酶升高、脂肪酶升高、高血糖症、心肌炎、血小板減少症、淋巴細胞減少症、急性膽管炎、急性肝炎、膿毒症、免疫介導性不良反應。
結論
HLX10在複發或轉移性實體瘤患者中的耐受性良好,單葯治療在多種腫瘤患者中表現出令人期待的抗腫瘤活性和持續緩解。HLX10的PK參數(包括清除)與納武單抗和派姆單抗相似。
此外,這項正在進行的臨床試驗,初步試驗結果有力地支持了HLX10聯合HLX04在實體瘤中的1期臨床試驗(NCT03757936),該聯合試驗也是國內首個獲新葯臨床試驗申請(IND)批准的國產單抗聯合治療方案,主要研究者為李進和郭燁教授;同時,HLX10的1期階段性結果也支持了另一項HLX10聯合化療用於轉移性鱗狀非小細胞肺癌的臨床試驗(NCT04033354)。
