近日,復宏漢霖正式收到國家藥品監督管理局關於其自主研製的HLX12——重組抗VEGFR2結構域II-III全人單克隆抗體注射液(以下簡稱“該新藥”)用於晚期胃癌或胃食管結合部腺癌、非小細胞肺癌、結直腸癌治療的臨床批准。
據悉,抗VEGFR2單抗是晚期癌症治療的有效靶向藥物,全球唯一上市的抗VEGFR2單克隆抗體為Ramucirumab(雷莫蘆單抗),在中國境內(不包括港澳台地區)尚無VEGFR2靶點的單抗藥品上市。
雷莫蘆單抗是特異性阻斷血管內皮生長因數受體2(VEGFR2)及下游血管生成相關通路的人源化單克隆抗體。多種腫瘤細胞中VEGFR2呈現高表達,抗VEGFR2抗體通過抑制它與其配體VEGF的結合或促進其降解可以阻斷生長信號的傳遞,從而抑制新生血管生成,使腫瘤無法進一步生長或蔓延。該新藥作為Ramucirumab的生物類似藥,一旦實現成功上市,將對VEGFR2靶向藥物的可及性和可負擔性帶來很大改善。
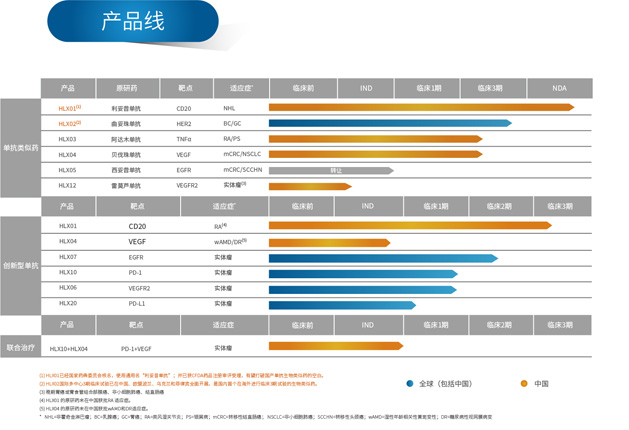
復宏漢霖積極踐行“仿創結合”的產品開發策略,已建立起成熟的單抗生物類似藥、生物改良型單抗以及創新型單抗的研究開發平台及極具競爭力的產品線。目前,管線中進度前四的重磅生物類似藥已全部進入3期臨床研究,而該新藥為代表的新產品仍在不斷加入。與此同時,復宏漢霖針對VEGFR2靶點開發出創新型單抗HLX06--重組抗VEGFR2全人單克隆抗體注射液。2017年6月和9月,HLX06已先後獲得國家食藥監總局的註冊審評受理以及美國FDA臨床試驗批准,成為繼HLX07之後復宏漢霖第二個實現三地臨床申報的創新單抗藥物。此外,復宏漢霖積極佈局單抗聯合治療,是國內少數同時擁有抗PD-1單抗和抗PD-L1單抗的企業,目前,復宏漢霖抗PD-1單抗HLX10和抗PD-L1單抗HLX20已分別獲得全球多地臨床批准,1期臨床試驗分別在中國台灣和澳大利亞順利開展。
關於復宏漢霖
上海復宏漢霖生物技術股份有限公司由復星醫藥與海外科學家團隊於2009年12月合資組建,公司主要致力於應用前沿技術進行生物類似藥、生物改良藥以及創新型單抗的研發及產業化,在中國上海、台北和美國加州均設有研發中心,產品覆蓋腫瘤、自身免疫性疾病等領域。
截至目前,復宏漢霖12個產品、1個聯合治療方案已完成20項適應症的臨床試驗申請,累計獲得全球範圍內27個臨床試驗許可(中國大陸17個,中國台灣3個,美國3個,歐盟、澳大利亞、烏克蘭和菲律賓各1個)。公司首個治療淋巴瘤的產品利妥昔單抗注射液(美羅華®生物類似藥)目前已獲國家食品藥品監督管理總局(現為國家藥品監督管理局)藥品註冊審評受理,有望打破國產生物類似藥市場的空白。
